Nhiệt độ nóng chảy và nhiệt độ sôi của hai chất HBr và HF như sau:
|
Nhiệt độ nóng chảy (oC) |
Nhiệt độ sôi (oC) |
|
|
? |
–86,9 |
–66,8 |
|
? |
–83,6 |
19,5 |
Hãy gán công thức chất thích hợp vào các ô có dấu?Hãy gán công thức chất thích hợp vào các ô có dấu?
- So sánh nhiệt độ sôi, nhiệt độ nóng chảy của HBr và HF, nhiệt độ nóng chảy và nhiệt độ sôi của phân tử phụ thuộc vào 2 yếu tố:
+ Khối lượng phân tử: khối lượng càng lớn thì nhiệt độ nóng chảy, nhiệt độ sôi càng cao.
+ Liên kết giữa các phân tử: số lượng liên kết giữa các phân tử càng nhiều lực liên kết càng mạnh khi đó cần nhiệt độ nóng chảy, nhiệt độ sôi cao đẻ phá vỡ liên kết của chúng.
- Điền công thức thích hợp vào ô có dấu ?
- Mặc dù HBr có khối lượng phân tử lớn hơn so với HF, nhưng nhiệt độ nóng chảy và nhiệt độ của HBr thấp hơn so với HF.
Do trong phân tử HF có các liên kết hydrogen, còn HBr không có liên kết hydrogen. Để phá vỡ được các liên kết hydrogen liên phân tử trong HF cần phải cung cấp năng lượng để phá vỡ liên kết và động năng để phân tử chuyển động nhiều hơn so với phân tử HBr. Khi đó nhiệt độ nóng chảy, nhiệt độ sôi của HF đều lớn hơn HBr.

- Điền công thức thích hợp vào ô có dấu ?
|
Chất |
Nhiệt độ nóng chảy (oC) |
Nhiệt độ sôi (oC) |
|
HBr |
–86,9 |
–66,8 |
|
HF |
–83,6 |
19,5 |

Các bài tập cùng chuyên đề
Bài 1 :
Ở áp suất khí quyển, nhiệt độ sôi của H2O là 1000C, CH4 là -161,580C, H2S là -60,280C. Vì sao các chất trên có nhiệt độ sôi khác nhau.Bài 2 :
Vẽ sơ đồ biểu diễn liên kết hydrogen giữa:
a) hai phân tử hydrogen fluoride (HF)
b) phân tử hydrogen fluoride (HF) và phân tử ammonia (NH3).
Bài 3 :
Những nguyên tử hydrogen nào trong phân tử ethanol (CH3CH2OH) không tham gia vào liên kết hydrogen? Vì sao
Bài 4 :
a) Cho dãy các phân tử C2H6, CH3OH, NH3. Phân tử nào trong dãy có thể tạo liên kết hydrogen? Vì sao?
b) Vẽ sơ đồ biểu diễn liên kết hydrogen giữa các phân tử đó?
Bài 5 :
Hai phân tử nước có thể liên kết được với nhau. Dựa vào sự phân bố điện tích trong phân tử nước (hình 12.1), cho biết liên kết giữa hai phân tử nước có thể được hình thành qua cặp nguyên tử nào?
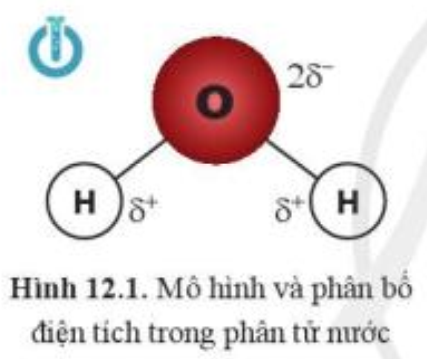
(1) O với O
(2) H với H
(3) O với H
Giải thích sự lựa chọn của em.
Bài 6 :
Vì sao nguyên tử H của của phân tử H2O không tạo được liên kết hydrogen với nguyên tử C của phân tử CH4?Bài 7 :
Viết các khả năng tạo thành liên kết hydrogen giữa một phân tử H2O và một phân tử NH3.
Bài 8 :
Vì sao HF có tính acid yếu hơn rất nhiều so với HCl? Biết rằng tính acid của một chất càng mạnh nếu phân tử đó càng dễ phân li thành ion H+.
Bài 9 :
Vẽ các liên kết hydrogen được hình thành giữa H2O với mỗi phân tử NH3, C2H5OH.
Bài 10 :
Hãy giải thích vì sao trong quá trình chưng cất rượu, C2H5OH bay trước H2O mặc dù khối lượng phân tử C2H5OH lớn hơn nhiều khối lượng phân tử H2O.
Bài 11 :
Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây?
A. CH4
B. NH3
C. H3C – O – CH3
D. PH3
Bài 12 :
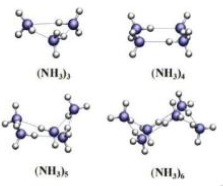
Một kết quả nghiên cứu mới đây cho thấy các phân tử NH3 có thể liên kết với nhau thành những cụm phân tử (NH3)n với n = 3 – 6. (Theo ACD Omega 2020, 5, 49, 31724-31729)
Vì sao các phân tử NH3 có thể hình thành được cụm phân tử này?
Bài 13 :
Giữa liên kết S-H và liên kết O-H, liên kết nào phân cực mạnh hơn? Vì sao?
Bài 14 :
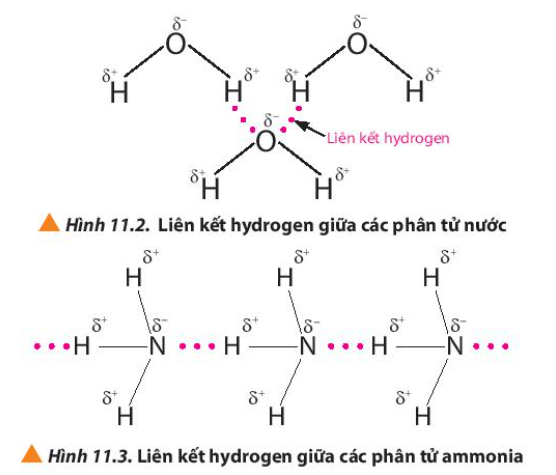
Quan sát các Hình 11.2 và 11.3, em hiểu thế nào là liên kết hydrogen giữa các phân tử?
Bài 15 :
So sánh độ bền của liên kết hydrogen với liên kết cộng hóa trị và liên kết ion
Bài 16 :
Điều gì đã khiến H2O có nhiệt độ sôi cao hơn H2S? Giải thíchBài 17 :
So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4. Giải thích
Bài 18 :
Giải thích vì sao một phân tử nước có thể tạo được liên kết hydrogen tối đa với bốn phân tử nước khác
Bài 19 :
Vì sao nên tránh ướp lạnh các lon bia, nước giải khát,… trong ngăn đá của tủ lạnh?Bài 20 :
Tại sao nhện nước có thể di chuyển trên mặt nước?
Bài 21 :
Hợp chất nào dưới đây được liên kết hydrogen liên phân tử
A. CH4
B. H2O
C. PH3
D. H2S
Bài 22 :
Biểu diễn liên kết hydrogen giữa các phân tử:
a) Hydrogen fluoride
b) Ethanol (C2H5OH) và nước
Bài 23 :
Trong hai chất ammonia (NH3) và phosphine (PH3), theo em chất nào có nhiệt độ sôi và độ tan trong nước lớn hơn? Giải thích
Bài 24 :
Ethylene glycol (HOCH2CH2OH) là một chất chống đông trong công nghiệp ô tô, hàng không do có khả năng can thiệp vào liên kết hydrogen của nước, làm các phân tử nước khó liên kết hơn, khiến nước khó đóng băng hơn. Biểu diễn liên kết hydrogen liên phân tử và nội phân tử trong ethylene glycol.
Bài 25 :
Biểu diễn liên kết hydrogen giữa các phân tử sau:
a) methanol (CH3OH) và nước.
b) ethylene glycol (HOCH2CH2OH) và nước.
Bài 26 :
Điều nào sau đây đúng khi nói về liên kết hydrogen nội phân tử?
A. Là lực hút giữa các proton của nguyên tử này với các electron ở nguyên tử khác.
B. Là lực hút tĩnh điện giữa nguyên tử H (thường trong các liên kết H-F, H-N, H-O) ở một phân tử với một trong các nguyên tử có độ âm điện mạnh (thường là N, O, F) ở ngay chính phân tử đó.
C. Là lực hút giữa các ion trái dấu.
D. Là lực hút giữa các phân tử có chứa nguyên tử hydrogen.
Bài 27 :
Điều nào sau đây đúng khi nói về liên kết hydrogen liên phân tử?
A. Là lực hút tĩnh điện giữa nguyên tử H (thường trong các liên kết H-F, H-N, H-O ở phân tử này) với một trong các nguyên tử có độ âm điện mạnh (thường là N, O, F) ở một phân tử khác.
B. Là lực hút giữa các phân tử khác nhau.
C. Là lực hút tĩnh điện giữa các ion trái dấu.
D. Là lực hút giữa các nguyên tử trong một hợp chất cộng hoá trị.
Bài 28 :
Sơ đồ nào sau đây thể hiện đúng liên kết hydrogen giữa 2 phân tử hydrogen fluoride (HF)?
A. \({H^{\delta + }} - {F^{\delta - }}...{H^{\delta + }} - {F^{\delta - }}\).
B. \({H^{\delta + }} - {F^{\delta + }}...{H^{\delta - }} - {F^{\delta - }}\).
C. \({H^{\delta - }} - {F^{\delta + }}...{H^{\delta - }} - {F^{\delta + }}\).
D. \({H^{\delta + }} - {F^{\delta - }}...{H^{\delta - }} - {F^{\delta + }}\).
Bài 29 :
Mặc dù chlorine có độ âm điện là 3,16 xấp xỉ với nitrogen là 3,04 nhưng giữa các phân tử HCl không tạo được liên kết hydrogen với nhau, trong khi giữa các phân tử NH3 tạo được liên kết hydrogen với nhau, nguyên nhân là do
A. độ âm điện của chlorine nhỏ hơn của nitrogen.
B. phân tử NH3 chứa nhiều nguyên tử hydrogen hơn phân tử HCl.
C. tổng số nguyên tử trong phân tử NH3 nhiều hơn so với phân tử HCl.
D. kích thước nguyên tử chlorine lớn hơn nguyên tử nitrogen nên mật độ điện tích âm trên chlorine không đủ lớn để hình thành liên kết hydrogen.
Bài 30 :
Hợp chất nào sau đây tạo được liên kết hydrogen liên phân tử?
A. H2S.
B. PH3.
C. HI.
D. CH3OH.


















Danh sách bình luận