Lớp ngoài cùng của nitrogen (Z = 7) có bao nhiêu electron, bao nhiêu AO?
N (Z = 7)
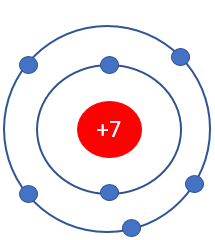
+ Lớp K có 2 electron.
+ Lớp L có 5 electron.
⇒ Lớp ngoài cùng có 5 electron và 3 AO.

Các bài tập cùng chuyên đề
Bài 1 :
Cấu hình electron của nguyên tử có Z = 16 là
A. 1s22s22p63s23p3
B. 1s22s22p63s23p5
C. 1s22s22p63s23p4
D. 1s22s22p63s23p5
Bài 2 :
Biểu diễn cấu hình electron của các nguyên tử có Z = 8 và Z = 11 theo ô orbitalBài 3 :
Silicon được sử dụng trong nhiều ngành công nghiệp: gốm, men sứ, thủy tinh, luyện thép, vật liệu bán dẫn,… Hãy biểu diễn cấu hình electron của nguyên tử silicon (Z = 14) theo ô orbital, chỉ rõ việc áp dụng các nguyên lí vững bền, nguyên lí Pauli và quy tắc HundBài 4 :
Chlorine (Z = 17) thường được sử dụng để khử trùng nước máy trong sinh hoạt. Viết cấu hình electron của nguyên tử chlorine và cho biết tại sao chlorine là phi kimBài 5 :
Viết được cấu hình electron nguyên tử của một số nguyên tố hóa học quen thuộc trong thực tế như: nitrogen, oxygen, aluminium… và dự đoán được tính chất hóa học cơ bản của chúngBài 6 :
Nguyên tử của nguyên tố sodium (natri) (Z = 11) có cấu hình electron là
A. 1s22s22p63s2
B. 1s22s22p6
C. 1s22s22p63s1
D. 1s22s22p53s2
Bài 7 :
Nguyên tử của nguyên tố nào sau đây có 3 electron thuộc lớp ngoài cùng
A. \({}_{11}^{23}Na\)
B. \({}_7^{14}N\)
C. \({}_{13}^{27}Al\)
D. \({}_6^{12}C\)
Bài 8 :
Viết cấu hình electron của các nguyên tố có số hiệu nguyên tử từ 1 đến 20
Bài 9 :
Biểu diễn cấu hình theo ô orbital (chỉ với lớp ngoài cùng) các nguyên tử có Z từ 1 đến 20. Xác định số electron độc thân của mỗi nguyên tử.
Bài 10 :
Những phát biểu nào sau đây là đúng?
(a) Orbital 1s có dạng hình cầu, orbital 2s có dạng hình số tám nổi.
(b) Trong một nguyên tử, năng lượng của electron thuộc AO 1s thấp hơn năng lượng của electron thuộc AO 2s.
(c) Trong một nguyên tử, năng lượng của electron thuộc AO 2s thấp hơn năng lượng của electron thuộc AO 2p.
(d) Trong một nguyên tử, năng lượng của electron thuộc AO 2s gần năng lượng của electron thuộc AO 2p.
Bài 11 :
Nguyên tử nguyên tố X có hai lớp electron, trong đó có một electron độc thân. Vậy X có thể là những nguyên tố nào?
Bài 12 :
Cấu hình electron của ion được thiết lập bằng cách thêm hoặc bớt electron, bắt đầu từ phân lớp ngoài cùng của cấu hình electron nguyên tử tương ứng.
a) Viết cấu hình electron của Na+ và Cl-.
b) Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp nào của Cl? AO đó là AO trống, chứa 1 hay 2 electron?
Bài 13 :
Cấu hình electron của một nguyên tử cho biết những thông tin gì?
Bài 14 :
Viết cấu hình electron nguyên tử của nguyên tố aluminium (Z = 13) và biểu diễn cấu hình electron của aluminium theo ô orbital. Từ đó, xác định số electron độc thân của nguyên tử này.Bài 15 :
Cho nguyên tố X có 2 lớp electron, lớp thứ 2 có 6 electron. Xác định số hiệu nguyên tử của X
Bài 16 :
Mỗi orbital nguyên tử chứa tối đa
A. 1 electron.
B. 2 electron.
C. 3 electron.
D. 4 electron.
Bài 17 :
Phát biểu nào sau đây đúng?
A. Những electron ở lớp K có mức năng lượng thấp nhất.
B. Những electron ở gần hạt nhân có mức năng lượng cao nhất.
C. Electron ở orbital 3p có mức năng lượng thấp hơn electron ở orbital 3s.
D. Các electron trong cùng một lớp có năng lượng bằng nhau.
Bài 18 :
Ở trạng thái cơ bản, trong nguyên tử, electron chiếm các mức năng lượng
A. lần lượt từ cao đến thấp.
B. lần lượt từ thấp đến cao
C. bất kì.
D. từ mức thứ hai trở đi.
Bài 19 :
Sự phân bố electron vào các lớp và phân lớp căn cứ vào
A. nguyên tử khối tăng dần.
B. điện tích hạt nhân tăng dần.
C. số khối tăng dần.
D. mức năng lượng electron.
Bài 20 :
Sự phân bố electron trên các phân lớp thuộc các lớp electron dựa vào nguyên lí hay quy tắc nào sau đây?
A. Nguyên lí vững bền và nguyên lí Pauli.
B. Nguyên lí vững bền và quy tắc Hund.
C. Nguyên lí Pauli và quy tắc Hund.
D. Nguyên lí vững bền và quy tắc Pauli.
Bài 21 :
Cho nguyên tử R có tổng số hạt cơ bản là 46, số hạt mang điện nhiều hơn số hạt không mang điện là 14. Cấu hình electron nguyên tử của R là
A. (Ne)3s23p3.
B. (Ne)3s23p5.
C. (Ar)3d14s2.
D. (Ar)4s2.
Bài 22 :
Tổng số hạt cơ bản của nguyên tử X là 13. Cấu hình electron của nguyên tử X là
A. 1s22s22p3.
B. 1s22s22p2.
C. 1s22s22p1.
D. 1s22s2.
Bài 23 :
Cho các nguyên tố có điện tích hạt nhân như sau: Z = 7, Z = 14 và Z = 21. Biểu diễn cấu hình electron của nguyên tử theo ô orbital. Tại sao lại phân bố như vậy?
Bài 24 :
Nguyên tử của nguyên tố X có electron cuối cùng điền vào phân lớp 3p1. Nguyên tử của nguyên tố Y có electron cuối cùng điền vào phân lớp 3p3. Số proton của X và Y lần lượt là
A. 13 và 15.
B. 12 và 14.
C. 13 và 14.
D. 12 và 15.
Bài 25 :
Nguyên tử của nguyên tố X có cấu hình electron đã xây dựng đến phân lớp 3d2. Tổng số electron của nguyên tử nguyên tố X là
A. 18.
B. 20.
C. 22.
D. 24.
Bài 26 :
Nguyên tử của nguyên tố Y có 14 electron ở lớp thứ ba. Thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng là 1s2s2p3s3p4s3d… Cấu hình electron của nguyên tử Y là
A. 1s22s22p63s24s23p6.
B. 1s22s22p63s23p63d64s2.
C. 1s22s22p63s23p63d8.
D. 1s22s22p63s23p63d6.
Bài 27 :
Nguyên tố Q có số hiệu nguyên tử bằng 14. Electron cuối cùng của nguyên tử nguyên tố Q điển vào lớp, phân lớp nào sau đây?
A. K, s.
B. L, p.
C. M, p.
D. N, d.
Bài 28 :
Nguyên tử của nguyên tố M có cấu hình electron là 1s22s22p4. Số electron độc thân của M là
A. 3.
B. 2.
C. 1.
D. 0.
Bài 29 :
Anion X2- có cấu hình electron lớp ngoài cùng là 3s23p6. Tổng số electron ở lớp vỏ của X2- là
A. 18.
B. 16.
C. 9.
D. 20.
Bài 30 :
Ion O2- không có cùng số electron với nguyên tử hoặc ion nào sau đây
A. Ne.
B. F-.
C. Cl-.
D. Mg2+.


















Danh sách bình luận