Đề bài
Phương trình nhiệt hoá học nào sau đây ứng với sơ đồ biểu diễn biến thiên enthalpy của phản ứng sau:
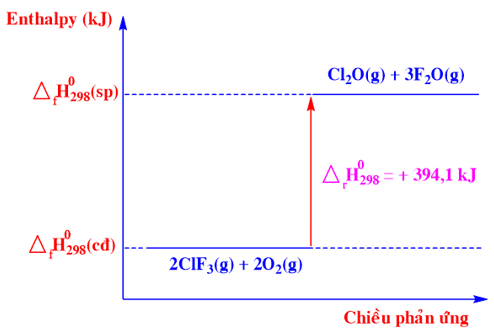
-
A.
Cl2O (g) + 3F2O (g) → 2ClF3 (g) + 2O2 (g) \({\Delta _r}H_{298}^0\) = -394,10 kJ
-
B.
Cl2O (g) + 3F2O(g) → 2ClF3 (g) + 2O2 (g) \({\Delta _r}H_{298}^0\) = +394,10 kJ
-
C.
2ClF3 (g) + 2O2 (g) → Cl2O (g) + 3F2O (g) \({\Delta _r}H_{298}^0\) = +394,10 kJ
-
D.
2ClF3 (g) + 2O2 (g) → Cl2O (g) + 3F2O (g) \({\Delta _r}H_{298}^0\) = -394,10 kJ
Phương pháp giải
Dựa vào sơ đồ biểu diễn biến thiên enthalpy
Lời giải của GV Loigiaihay.com
Chất tham gia: ClF3(g) và O2(g)
Chất sản phẩm: Cl2O(g) và F2O(g)
Biến thiên enthalpy của phản ứng là: \({\Delta _r}H_{298}^0\) = +394,10 kJ
=>2ClF3 (g) + 2O2 (g) → Cl2O (g) + 3F2O (g) \({\Delta _r}H_{298}^0\) = +394,10 kJ
Đáp án : C

Các bài tập cùng chuyên đề


















Danh sách bình luận