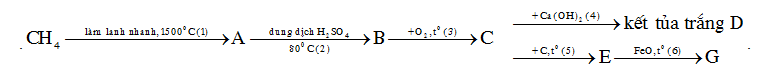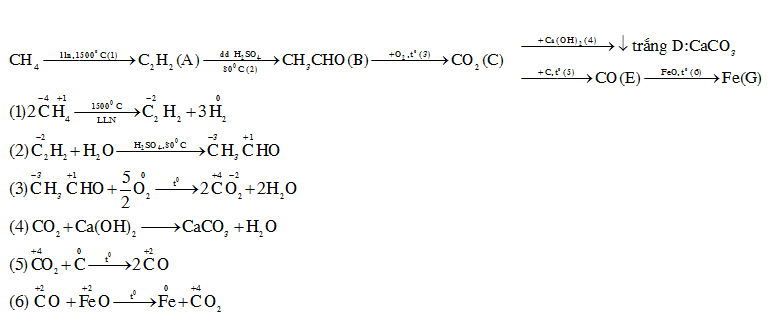Đề thi thử THPT QG trường THPT chuyên Hà Tĩnh lần 1Đề bài
Câu 1 :
Tơ được sản xuất từ xenlulozo là
Câu 2 :
Số este mạch hở có công thức phân từ C4H6O2 có thể phản ứng với brom trong nước theo tỉ lệ mol neste : nbrom = 1:2 là
Câu 3 :
Các khí thải công nghệp và của các động cơ ô tô, xe máy… là nguyên nhân chủ yếu gây ra mưa axit. Thành phần hóa học chủ yếu trong khí thải trực tiếp gây ra mưa axit là
Câu 4 :
Hỗn hợp X gồm saccarozo và glucozo cùng số mol được đun nóng với lượng dư dung dịch AgNO3/NH3 thu được 3 gam Ag. Nếu thủy phân hoàn toàn hỗn hợp rồi mới cho sản phẩm thực hiện phản ứng tráng bạc thì lượng Ag tối đa có thể thu được là
Câu 5 :
Để 4,2 gam sắt trong không khí một thời gian thu được 5,32 gam hỗn hợp X gồm sắt và các oxit của nó. Hòa tan hết X bằng dung dịch HNO3, thấy sinh ra 0,448 lít NO (đktc, sản phẩm khử duy nhất) và dung dịch Y. Cô cạn Y thu được m gam muối khan. Giá trị m là
Câu 6 :
Phát biểu nào sau đây là đúng?
Câu 7 :
Thực hiện các thí nghiệm sau (a) Đun nóng hỗn hợp bột Fe dư và H2SO4 loãng (b) Cho Fe vào dung dịch KCl (c) Cho Fe(OH)2 vào dung dịch HNO3 loãng dư (d) Đốt dây sắt trong Cl2 (e) Cho Fe3O4 vào dung dịch H2SO4 loãng dư Số thí nghiệm có tạo ra muối sắt II là
Câu 8 :
Amin nào sau đây là amin bậc 2:
Câu 9 :
Kim loại nào sau đây không phải kim loại kiềm
Câu 10 :
Thành phần chính của quặng boxit là
Câu 11 :
Cho các phát biểu sau: (1) Kim loại Cr được điều chế bằng phản ứng nhiệt nhôm. (2) Cho Mg dư vào dung dịch FeCl3, kết thúc phản ứng thu được dung dịch chứa hai muối (3) Cho Al vào dung dịch H2SO4 loãng có lẫn CuCl2 có xảy ra ăn mòn hóa học (4) Cho AgNO3 tác dụng với dung dịch FeCl3, thu được kim loại Ag (5) Điện phân dung dịch KCl với điện cực trơ thu được khí O2 ở catot (6) Kim loại K khử được ion Cu2+ trong dung dịch CuSO4 Số phát biểu không đúng là
Câu 12 :
Tiến hành các thí nghiệm sau: (a) Cho kim loại Na vào dung dịch CuSO4 (b) Dẫn khí CO dư qua Al2O3 nung nóng (c) Cho kim loại Mg vào dung dịch CuSO4 (d) Điện phân dung dịch CaCl2 có màng ngăn Số thí nghiệm thu được kim loại là
Câu 13 :
Cho các polime sau: tơ nilon- 6,6;poli vinyl clorua; poli(vinyl axetat); teflon, tơ visco, tơ nitron; poli buta-1,3-đien. Số polime được điều chế bằng phản ứng trùng hợp là
Câu 14 :
Chất thuộc loại cacbohiđrat là
Câu 15 :
Chất gây ra mùi thơm của quả chuối thuộc loại
Câu 16 :
M là kim loại nhóm IA, oxit của M có công thức là
Câu 17 :
Cho các chất sau: phenol, anilin, buta-1,3-đien, metyl acrylat, toluen, stiren, axit metarylic. Số chất tác dụng được với nước brom ở điều kiện thường là
Câu 18 :
Lấy 0,3 mol hỗn hợp X gồm H2NC3H5(COOH)2 và H2NCH2COOH cho vào 400 ml dung dịch HCl 1M thì thu đựơc dung dịch Y. Y tác dụng vừa đủ với 800 ml dung dịch NaOH 1M thu được dung dịch Z. Bay hơi Z thu được m gam chất rắn khan. Giá trị của m là
Câu 19 :
Kim loại nào sau đây có thể điều chế được phương pháp nhiệt luyện?
Câu 20 :
Để làm sạch lớp cặn trong các dụng cụ đun và chứa nước nóng, người ta dùng
Câu 21 :
Cho hỗn hợp gồm Fe và Cu lần lượt tác dụng với các chất lỏng sau: (1) dung dịch H2SO4 loãng nguội (2) khí oxi nung nóng (3) dung dịch NaOH (4) dung dịch H2SO4 đặc nguội (5) dung dịch FeCl3 Số chất chỉ tác dụng với một trong hai kim loại là
Câu 22 :
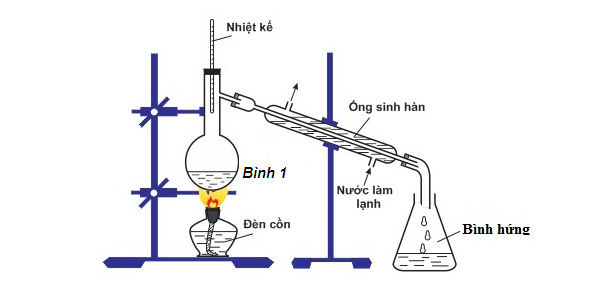
Bộ dụng cụ chưng cất (được mô tả như hình vẽ sau) thường dùng đề
Câu 23 :
Kim loại nào sau đây có khối lượng riêng nhỏ nhất
Câu 24 :
Dãy gồm các chất cùng tồn tại trong một dung dịch là
Câu 25 :
Cho 21,6 gam bột Mg tan hết trong dung dịch hỗn hợp gồm NaNO3 và NaHSO4 thu được dung dịch X chỉ chứa m gam hỗn hợp muối trung hòa và 5,6 lít hỗn hợp khí Y gồm N2O và H2( tỉ khối của Y so với H2 là 13,6). Giá trị gần nhất của m là
Câu 26 :
Cho các phát biểu sau (1) Thành phần chính của supephotphat kép gồm hai muối Ca(H2PO4)2 và CaSO4 (2) Al là kim loại có tính lưỡng tính (3) Để xử lý thủy ngân rơi vãi, người ta có thể dùng bột lưu huỳnh (4) Khí thoát vào khí quyển, Freon phá hủy tầng ozon (5) Trong khí quyển, nồng độ NO2 và SO2 vượt quá tiêu chuẩn cho phép gây ra hiện tượng mưa axit (6) Đám cháy Mg có thể dập tắt bằng CO2 (7) Phèn chua được dùng để làm trong nước đục (8) Trong tự nhiên, các kim loại kiềm chỉ tồn tại dạng đơn chất Số phát biểu đúng là
Câu 27 :
Cho các phát biểu sau: (a) mọi este khi xà phòng hóa đều tạo ra muối và ancol (b) Fructozo có nhiều trong mật ong (c) Liên kết của nhóm CO và nhóm NH giữa các aminoaxit là liên kết peptit (d) Amilopectin, tơ tằm, lông cừu là polime thiên nhiên (e) Cao su Buna-S được điều chế bằng phản ứng trùng ngưng (f) Tinh bột và xenlulozo là đồng phân của nhau (g) Protein dạng sợi dễ dàng tan trong nước tạo thành dung dịch keo (h) Amilozo và amylopectin đều có các liên kết α – 1,4 – glicozit Số phát biểu đúng là
Câu 28 :
Hỗn hợp A gồm hai chất hữu cơ X(đơn chức) và Y( chứa 3 nhóm chức cùng loại) đểu tác dụng với dung dịch NaOH. Để tác dụng với m gam A cần vừa đủ 300 ml dung dịch KOH 1M. Sau khi phản ứng xảy ra hoàn toàn thu được 33,6 gam muối của một axit hữu cơ và 4,6 gam một ancol. Đốt cháy hoàn toàn lượng ancol trên thu được 3,36 lít CO2 (đktc) và 3,6 gam H2O. Tổng số nguyên tử trong một phân tử X gần nhất với số nào sau đây
Câu 29 :
Hỗn hợp X gồm metan, eten, propin. Nếu cho 13,4 gam hỗn hợp X tác dụng với dd AgNO3/NH3 dư thì thu đươc 14,7 gam kết tủa. Nếu cho 16,8 lít hỗn hợp X (đktc) tác dụng với dung dịch brom thì thấy có 108 gam Br2 phản ứng. Phần trăm thể tích CH4 trong hỗn hợp X là
Câu 30 :
Cho m gam hỗn hợp Na và Ba vào nước dư, thu được dung dịch X và V lít khí H2 đktc. Sục khí CO2 từ từ đến dư vào dung dịch X, lượng kết tủa thể hiện trên đồ thị sau Giá trị của m và V lần lượt là
Câu 31 :
Este X có đặc điểm sau: - Đốt cháy hoàn toàn X tạo thành CO2 và H2O có số mol bằng nhau - Thủy phân X trong môi trường axit thu được chất Y ( tham gia phản ứng tráng gương) và chất Z (có số nguyên tử cacbon bằng một nửa số cacbon trong X) Có các phát biểu sau : (1) Chất X thuộc loại este no, đơn chức (2) Chất Y tan vô hạn trong nước (3) Đun Z với dung dịch H2SO4 đặc ở 170oC thu được anken (4) Trong điều kiện thường Z ở trạng thái lỏng (5) X có thể hòa tan Cu(OH)2 tạo ra dung dịch màu xanh Số phát biểu đúng là
Câu 32 :
Cho các dung dịch sau: Na2CO3; Na2S,CuS, Na2SO4, Fe(NO3)2, FeSO4, Fe(NO3)3 , CH3NH3HCO3, CH3COONa lần lượt vào dung dịch HCl. Số trường hợp có khí thoát ra là
Câu 33 :
Hòa tan hoàn toàn 192,07 gam hỗn hợp NaHSO4 và Fe(NO3)3 vào nước được dung dịch X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO và Al2O3( trong đó oxi chiếm 30% về khối lượng) tan hết vào X. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch chỉ chứa muối trung hòa và 2,016 lít hỗn hợp khí T có tổng khối lượng 1,84 gam gồm 5 khí đktc, trong đó H2,N2O, NO2 lần lượt có số mol là 0,04; 0,01; 0,01. Cho BaCl2 dư vào Z thu được 356,49 gam kết tủa. Giá trị của m gần nhất với giá trị nào sau đây?
Câu 34 :
Hỗn hợp X có công thức C12H14O4 . Từ X thực hiện các phản ững sau (a) X + 2NaOH → X1 + 2X2 (b) X1 + H2SO4 → X3 + Na2SO4 (c) nX3 + nX4 → poli(etylen terephtalat) +2nH2O (d) X2 + X3 → X5 + H2O Có các phát biểu sau (1) Khi đốt cháy hoàn toàn 1 mol X1 cho 7 mol CO2 (2) Các chất X1,X2,X3 đều tác dụng với Na (3) Phân tử khối của X5 bằng 222 (4) Các chất X3 và X4 đều là hợp chất đa chức (5) Phản ứng (c) thuộc loại phản ứng trùng hợp (6) Phân tử X5 có 3 liên kết ∏ Số phát biểu đúng là
Câu 35 :
X, Y ( MX < MY) là 2 axit kế tiếp thuộc cùng một dãy đồng đẳng axit fomic, Z là este hai chức của X,Y và ancol T. Đốt cháy 25,04 gam hỗn hợp E chứa X, Y, Z, T đều mạch hở cần dùng 16,576 lít khí O2 (đktc) thu được 14,4 gam nước. Mặt khác, đun nóng 12,52 gam E cần dung 380 ml dung dịch NaOH 0,5M. Biết rằng ở điều kiện thường, ancol T không tác dụng được với Cu(OH)2 . Phần trăm khối lượng của X có trong hỗn hợp E gần nhất với :
Câu 36 :
Cho sơ đồ phản ứng sau
Số phản ứng oxi hóa khử là
Câu 37 :
Hỗn hợp X gồm một axit cacboxylic hai chức, no, mạch hở, hai ancol no đơn chức kế tiếp nhau trong dãy đồng đẳng và một đieste tạo bởi axit và 2 ancol đó. Đốt cháy hoàn toàn 4,84 gam X thu được 7,26 gam CO2 và 2,7 gam nước. Mặt khác, đun nóng 4,84 gam X trên với 80 ml dung dịch NaOH 1M, sau phản ứng xảy ra hoàn toàn thêm vừa đủ 10 ml dung dịch HCl 1M để trung hòa lượng NaOH dư thu được dung dịch Y. Cô cạn dung dịch Y thu được m gam muối khan, đồng thời thu được 896 ml hỗn hợp ancol (ở điều kiện tiêu chuẩn) có tỉ khối hơi so với H2 là 19,5. Giá trị của m gần nhất với số nào sau đây
Câu 38 :
Cho 7,65 gam hỗn hợp Al và Mg tan hoàn toàn trong 500 ml dung dịch gồm HCl 1,04M và H2SO4 0,28M, thu được dung dịch X và khí H2. Cho 850 ml dung dịch NaOH 1M vào X, sau phản ứng hoàn toàn thu được 16,5 gam kết tủa gồm hai chất. Mặt khác, cho từ từ dung dịch hỗn hợp KOH 0,8M và Ba(OH)2 0,1M vào X đến khi lượng kết tủa lớn nhất, lọc kết tủa đem nung đến khối lượng không đổi, thu được m gam chất rắn. Giá trị của m gần nhất với giá trị nào sau đây
Câu 39 :
X là este của aminoaxit; Y và Z là hai peptit(MY < MZ, hơn kém nhau một nguyên tử nito trong phân tử). X,Y và Z đều mạch hở. Cho 60,17 gam hỗn hợp E gồm X, Y, Z tác dụng vừa đủ với 0,73 mol NaOH, sau phản ứng thu được 73,75 gam ba muối của glyxin, alanin và valin( trong đó có 0,15 mol muối alanin)và 14,72 gam ancol no, đơn chức, mạch hở. Mặt khác, đốt cháy 60,17 gam E trong O2 dư thu được CO2, N2 và 2,275 mol H2O. Phần trăm khối lượng của Y trong E có giá trị gần nhất là
Câu 40 :
Điện phân dung dịch X chứa a mol Cu(NO3)2 và 0,2 mol NaCl (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) trong thời gian t giây, thu được 3,36 lít khí ở anot( đktc) và dung dịch Y. Nếu thời gian điện phân là 2t giây thì tổng thể tích khí thu được ở cả 2 điện cực là 7,84 lít (đktc). Cho dung dịch Y phản ứng tối đa với m gam Fe tạo ra khí NO(sản phẩm khử duy nhất). Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của m là
Lời giải và đáp án
Câu 1 :
Tơ được sản xuất từ xenlulozo là
Đáp án : A Phương pháp giải :
Dựa vào kiến thức về xenlulozo hóa 12 Lời giải chi tiết :
Tơ được sản xuất từ xenlulozo là tơ visco
Câu 2 :
Số este mạch hở có công thức phân từ C4H6O2 có thể phản ứng với brom trong nước theo tỉ lệ mol neste : nbrom = 1:2 là
Đáp án : A Phương pháp giải :
Vì este có thể phản ứng với brom trong nước theo tỉ lệ mol neste : nbrom = 1:2 nên đây là este của HCOOH và có 1 nối đôi Lời giải chi tiết :
Vì este có thể phản ứng với brom trong nước theo tỉ lệ mol neste : nbrom = 1:2 nên đây là este của HCOOH và có 1 nối đôi => các CTCT thỏa mãn là HCOOCH=CHCH2 (2 đồng phân hình học) HCOOCH2 – CH = CH2 HCOOC(CH3) = CH2 => Có 4 este thỏa mãn
Câu 3 :
Các khí thải công nghệp và của các động cơ ô tô, xe máy… là nguyên nhân chủ yếu gây ra mưa axit. Thành phần hóa học chủ yếu trong khí thải trực tiếp gây ra mưa axit là
Đáp án : B Phương pháp giải :
Dựa vào nguyên nhân gây mưa axit sgk hóa 12 Lời giải chi tiết :
Thành phần hóa học chủ yếu trong khí thải trực tiếp gây ra mưa axit là NO,SO2, NO2
Câu 4 :
Hỗn hợp X gồm saccarozo và glucozo cùng số mol được đun nóng với lượng dư dung dịch AgNO3/NH3 thu được 3 gam Ag. Nếu thủy phân hoàn toàn hỗn hợp rồi mới cho sản phẩm thực hiện phản ứng tráng bạc thì lượng Ag tối đa có thể thu được là
Đáp án : A Phương pháp giải :
X +AgNO3/NH3 thì : C6H12O6 \(\xrightarrow{{ + AgN{O_3} + N{H_3}}}2Ag\) => nC6H12O6 = ½ . nAg Khi X thủy phân thì C12H22O11 + H2O $ \to $ C6H12O6 (glucozo) + C6H12O6 (fructozo) Vì cả glucozo và fructozo đều có phản ứng tráng bạc giống nhau nên ta coi thủy phân X chủ thu được glucozo Lời giải chi tiết :
X +AgNO3/NH3 thì : C6H12O6 \(\xrightarrow{{ + AgN{O_3} + N{H_3}}}2Ag\) => nC6H12O6 = ½ . nAg = 0,014 mol Khi X thủy phân thì C12H22O11 + H2O \( \to \) C6H12O6 (glucozo) + C6H12O6 (fructozo) Vì cả glucozo và fructozo đều có phản ứng tráng bạc giống nhau nên ta coi thủy phân X chủ thu được glucozo Và nglucozo = 2nsaccarozo + nglucozo ban đầu = 2.0,014 + 0,014 = 0,042 mol Nên nAg = 2nglucozo = 0,084 mol => mAg = 9 g
Câu 5 :
Để 4,2 gam sắt trong không khí một thời gian thu được 5,32 gam hỗn hợp X gồm sắt và các oxit của nó. Hòa tan hết X bằng dung dịch HNO3, thấy sinh ra 0,448 lít NO (đktc, sản phẩm khử duy nhất) và dung dịch Y. Cô cạn Y thu được m gam muối khan. Giá trị m là
Đáp án : D Phương pháp giải :
Quy đổi X thành Fe và O Bảo toàn Fe => nFe(X) =? Bảo toàn khối lượng có mO => nO Khi cho X + HNO3 thì : Fe → Fe+3 + 3e O + 2e → O-2 Fe → Fe+2 + 2e N+5 + 3e → N+2 Lời giải chi tiết :
Quy đổi X thành Fe và O Bảo toàn Fe thì nFe(X) =4,2 : 56 = 0,075 mol Bảo toàn khối lượng có mO = mX – mFe= 5,32 – 4,2 = 1,12 g => nO = 0,07 mol Khi cho X + HNO3 thì : Fe → Fe+3 + 3e O + 2e → O-2 Fe → Fe+2 + 2e N+5 + 3e → N+2 Đặt Fe+2 : x mol và Fe+3 : y mol Bảo toàn e có 2x + 3y = 2nO + 3nNO → 2x+ 3y = 2.0,07 + 0,02.3 = 0,2 mol e Ta có nFe = x + y = 0,075 mol nên x = 0,025 mol và y = 0,05 mol => muối thu được có 0,025 mol Fe(NO3)2 và 0,05 mol Fe(NO3)3 => mmuối = 0,025.180 + 0,05.242 =16,6
Câu 6 :
Phát biểu nào sau đây là đúng?
Đáp án : D Phương pháp giải :
Xem lại TCHH của glucozo, saccarozo, tinh bột Lời giải chi tiết :
A sai vì xenlulozo có cấu trúc mạch thẳng B sai saccarozo không làm mất màu nước brom C sai vì glucozo bị oxi hóa bởi dung dịch AgNO3/NH3 D đúng
Câu 7 :
Thực hiện các thí nghiệm sau (a) Đun nóng hỗn hợp bột Fe dư và H2SO4 loãng (b) Cho Fe vào dung dịch KCl (c) Cho Fe(OH)2 vào dung dịch HNO3 loãng dư (d) Đốt dây sắt trong Cl2 (e) Cho Fe3O4 vào dung dịch H2SO4 loãng dư Số thí nghiệm có tạo ra muối sắt II là
Đáp án : B Phương pháp giải :
Viết PTHH, chọn các thí nghiệm thu được muối sắt (II) Chú ý đến chất cho hết, chất cho dư ở dữ kiện các chất tham gia phản ứng. Lời giải chi tiết :
(a) Fe dư + H2SO4 loãng → FeSO4 + H2 => tạo muối FeSO4 (b) không phản ứng (c) 3Fe(OH)2 + 10HNO3 → 3Fe(NO3)3 + NO + 8H2O => tạo muối Fe(NO3)3 (d) Fe + Cl2 \(\xrightarrow{{{t^0}}}\) FeCl3 => tạo muối FeCl3 (e) Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O => tạo 2 muối FeSO4 và Fe2(SO4)3 Số thí nghiệm có tạo ra muối sắt II là 2
Câu 8 :
Amin nào sau đây là amin bậc 2:
Đáp án : D Phương pháp giải :
Bậc của amin là số nguyên tử H trong phân tử NH3 bị thay thế bằng nhóm ankyl Lời giải chi tiết :
amin bậc 2 là CH3-NH- CH3 3 chất còn lại là amin bậc 1
Câu 9 :
Kim loại nào sau đây không phải kim loại kiềm
Đáp án : A Phương pháp giải :
Xem lại các kim loại kiềm nhóm IA Lời giải chi tiết :
Ca là kim loại kiềm thổ
Câu 10 :
Thành phần chính của quặng boxit là
Đáp án : B Phương pháp giải :
Xem lại CTHH của các chất trong quặng Lời giải chi tiết :
Thành phần chính của quặng boxit là Al2O3
Câu 11 :
Cho các phát biểu sau: (1) Kim loại Cr được điều chế bằng phản ứng nhiệt nhôm. (2) Cho Mg dư vào dung dịch FeCl3, kết thúc phản ứng thu được dung dịch chứa hai muối (3) Cho Al vào dung dịch H2SO4 loãng có lẫn CuCl2 có xảy ra ăn mòn hóa học (4) Cho AgNO3 tác dụng với dung dịch FeCl3, thu được kim loại Ag (5) Điện phân dung dịch KCl với điện cực trơ thu được khí O2 ở catot (6) Kim loại K khử được ion Cu2+ trong dung dịch CuSO4 Số phát biểu không đúng là
Đáp án : C Phương pháp giải :
Dựa vào kiến thức về chương kim loại sgk hóa 12 Lời giải chi tiết :
(1) đúng VD: Cr2O3 + 2Al \(\xrightarrow{{{t^0}}}\) 2Cr + Al2O3 (2) sai vì Mg dư chỉ thu muối được 1 muối MgCl2. PTHH: Mg + 2FeCl3 → 2FeCl2 + MgCl2 Mg + FeCl2 \( \to\) MgCl2 + Fe (3) đúng vì ban đầu xảy ra ăn hóa học Al + CuCl2 rồi mới ăn mòn điện hóa (4) sai cho AgNO3 tác dụng với dung dịch FeCl3, thu được AgCl PTHH: 3AgNO3 + FeCl3 → Fe(NO3)3 + 3AgCl↓ (5) sai vì điện phân dung dịch KCl với điện cực trơ thu được khí O2 ở anot (6) sai vì K sẽ tác dụng ngay với nước tạo thành KOH nên không khử được Cu+2 => Số phát biểu không đúng là 4
Câu 12 :
Tiến hành các thí nghiệm sau: (a) Cho kim loại Na vào dung dịch CuSO4 (b) Dẫn khí CO dư qua Al2O3 nung nóng (c) Cho kim loại Mg vào dung dịch CuSO4 (d) Điện phân dung dịch CaCl2 có màng ngăn Số thí nghiệm thu được kim loại là
Đáp án : A Phương pháp giải :
Viết PTHH xảy ra Lời giải chi tiết :
(a) Na + H2O → NaOH + H2↑ 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓ (b) CO không có pư vói Al2O3 nung nóng (c) Mg + CuSO4 → MgSO4 + Cu↓ (d) CaCl2 + H2O \(\xrightarrow{{DPMN}}\) Ca(OH)2 + H2↑ + Cl2↑ chỉ có 1 thí nghiệm (c) thu được kim loại
Câu 13 :
Cho các polime sau: tơ nilon- 6,6;poli vinyl clorua; poli(vinyl axetat); teflon, tơ visco, tơ nitron; poli buta-1,3-đien. Số polime được điều chế bằng phản ứng trùng hợp là
Đáp án : A Phương pháp giải :
Xem lại Polime sgk hóa 12 Lời giải chi tiết :
Số polime được điều chế bằng phản ứng trùng hợp là poli(vinyl axetat), teflon, tơ nitron; poli buta-1,3-đien, poli vinyl clorua => có 5 pilime được điều chế bằng pư trùng hợp
Câu 14 :
Chất thuộc loại cacbohiđrat là
Đáp án : B Phương pháp giải :
Cacbohidrat là hợp chất hữu cơ có CTPT dạng Cn(H2O)n Lời giải chi tiết :
Chất thuộc loại cacbohiđrat là xenlulozơ Glixerol thuộc nhóm ancol, protein thuộc nhóm peptit, PVC thuộc nhóm polime
Câu 15 :
Chất gây ra mùi thơm của quả chuối thuộc loại
Đáp án : D Phương pháp giải :
Xem lại bài este chất tạo mùi của chuối là isoamyl axetat Lời giải chi tiết :
Chất gây ra mùi thơm của qua chuổi thuộc loại este (chất đấy là isoamyl axetat CH3COOC5H11)
Câu 16 :
M là kim loại nhóm IA, oxit của M có công thức là
Đáp án : D Phương pháp giải :
Kim loại nhóm IA có hóa trị I => theo quy tắc hóa trị thành lập được công thức của M với oxi Lời giải chi tiết :
M là kim loại nhóm IA, oxit của M có công thức là M2O (vì M có hóa trị I)
Câu 17 :
Cho các chất sau: phenol, anilin, buta-1,3-đien, metyl acrylat, toluen, stiren, axit metarylic. Số chất tác dụng được với nước brom ở điều kiện thường là
Đáp án : A Phương pháp giải :
Chất tác dụng với nước brom ở điều kiện thường là phenol, anilin và các chất chứa liên kết bội Lời giải chi tiết :
Chất tác dụng được với nước brom ở điều kiện thường là phenol, anilin, buta-1,3-đien, metyl acrylat, stiren, axit metarylic => có 6 chất
Câu 18 :
Lấy 0,3 mol hỗn hợp X gồm H2NC3H5(COOH)2 và H2NCH2COOH cho vào 400 ml dung dịch HCl 1M thì thu đựơc dung dịch Y. Y tác dụng vừa đủ với 800 ml dung dịch NaOH 1M thu được dung dịch Z. Bay hơi Z thu được m gam chất rắn khan. Giá trị của m là
Đáp án : D Phương pháp giải :
X là các amino axit X + 0,4 mol HCl rồi thu sản phầm tác dụng với 0,8 mol NaOH thì ta coi như hỗn hợp X và HCl tác dụng với NaOH. PTHH : H2NC3H5(COOH)2 + 2NaOH → H2NC3H5(COONa)2 + 2H2O H2CH2COOH + NaOH → H2NCH2COONa + H2O HCl + NaOH → H2O + NaCl Đặt số mol từng chất trong X rồi lập hệ 2 ẩn hai phương trình giải Lời giải chi tiết :
X là các amino axit X + 0,4 mol HCl rồi thu sản phầm tác dụng với 0,8 mol NaOH thì ta coi như hỗn hợp X và HCl tác dụng với NaOH. PTHH : H2NC3H5(COOH)2 + 2NaOH → H2NC3H5(COONa)2 + 2H2O a mol 2a a H2CH2COOH + NaOH → H2NCH2COONa + H2O b b b HCl + NaOH → H2O + NaCl 0,4 0,4 0,4 Ta có hệ phương trình sau \(\left\{ \begin{gathered}a + b = 0,3 \hfill \\2a + b + 0,4 = 0,8 \hfill \\\end{gathered} \right. \to \left\{\begin{gathered}a = 0,1 \hfill \\b = 0,2 \hfill \\\end{gathered} \right.\) Nên mmuối = mH2NC3H5(COONa)2 + mH2NCH2COONa + mNaCl = 0,1.191+0,2.97+0,4.58.5=61,9 g
Câu 19 :
Kim loại nào sau đây có thể điều chế được phương pháp nhiệt luyện?
Đáp án : D Phương pháp giải :
Kim loại điều chế bằng phươn pháp nhiệt luyện là những kim loại yếu hoặc trung bình như Cu, Ag... Lời giải chi tiết :
Kim loại có thể điều chế được phương pháp nhiệt luyện Cu
Câu 20 :
Để làm sạch lớp cặn trong các dụng cụ đun và chứa nước nóng, người ta dùng
Đáp án : D Phương pháp giải :
Cặn trong ấm nước là các muối kết tủa CaCO3, MgCO3 => chọn chất có khả năng hòa tan được muối này sẽ làm sạch được cặn ấm Lời giải chi tiết :
Cặn trong ấm nước là các muối kết tủa CaCO3, MgCO3 Để làm sạch lớp cặn trong các dụng cụ đun và chứa nước nóng, người ta dùng giấm ăn, vì giấm ăn có khả năng hòa tan được các muối kết tủa CaCO3, MgCO3 theo pư 2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2 2CH3COOH + MgCO3 → (CH3COO)2Mg + H2O + CO2
Câu 21 :
Cho hỗn hợp gồm Fe và Cu lần lượt tác dụng với các chất lỏng sau: (1) dung dịch H2SO4 loãng nguội (2) khí oxi nung nóng (3) dung dịch NaOH (4) dung dịch H2SO4 đặc nguội (5) dung dịch FeCl3 Số chất chỉ tác dụng với một trong hai kim loại là
Đáp án : C Phương pháp giải :
Viết PTHH Lời giải chi tiết :
(1) dung dịch H2SO4 loãng nguội chỉ tác dụng với Fe (2) khí oxi nung nóng tác dụng với cả hai (3) dung dịch NaOH không tác dụng với cả hai (4) dung dịch H2SO4 đặc nguội chỉ tác dụng với Cu (5) dung dịch FeCl3 tác dụng với cả 2 Số chất chỉ tác dụng với một trong hai kim loại là (1) và (4) => có 2 chất
Câu 22 :
Bộ dụng cụ chưng cất (được mô tả như hình vẽ sau) thường dùng đề
Đáp án : B Phương pháp giải :
Dựa vào kĩ năng quan sát hình vẽ, nhiệt kế được cắm vào phần nào của dụng cụ => từ đó dự đoán được mục đích của dụng cụ Lời giải chi tiết :
Quan sát ta thấy có nhiệt kế cắm trên thành bình chưng cất => bộ dụng cụ chưng cất trên thường dùng đề tách các chất lỏng có nhiệt độ sôi khác nhau
Câu 23 :
Kim loại nào sau đây có khối lượng riêng nhỏ nhất
Đáp án : C Phương pháp giải :
Xem lại lý thuyết bài đại cương kim loại Lời giải chi tiết :
Kim loại có khối lượng riêng nhỏ nhất là Li
Câu 24 :
Dãy gồm các chất cùng tồn tại trong một dung dịch là
Đáp án : C Phương pháp giải :
Các chất không có phản ứng với nhau sẽ cùng tồn tại được trong 1 dung dịch. Lời giải chi tiết :
Dãy gồm các chất cùng tồn tại trong một dung dịch là H2SO4; HNO3; Fe(NO3)3. A không tồn tại do Fe2+ tác dụng với H+ và NO3- B không tồn tại vì Ag+ tác dụng với Cl- D không tồn tại vì OH- tác dụng với HCO3- và HPO42-
Câu 25 :
Cho 21,6 gam bột Mg tan hết trong dung dịch hỗn hợp gồm NaNO3 và NaHSO4 thu được dung dịch X chỉ chứa m gam hỗn hợp muối trung hòa và 5,6 lít hỗn hợp khí Y gồm N2O và H2( tỉ khối của Y so với H2 là 13,6). Giá trị gần nhất của m là
Đáp án : C Phương pháp giải :
Xét hỗn hợp khí Y có N2O : x mol và H2 : y mol Có nY = x + y mol và mY = MY . nY = 44a + 2y => giải được x và y Xét phản ứng Mg tác dụng với NaNO3 và NaHSO4 thì 4Mg + 10H+ + 2NO3- → 4Mg+2 + 5H2O + N2O Mg +2H+ → Mg+2 + H2 So sánh 4nN2O + nH2 với nMg nếu nhỏ hơn thì phản ứng có tạo ra NH4+ : 4Mg + 10H+ + NO3- → 4Mg+2 + 3H2O + NH4+ Bảo toàn nguyên tố N có nNaNO3 Bảo toàn nguyên tố H có nNaHSO4 => các ion trong X => mmuối = mion Lời giải chi tiết :
Xét hỗn hợp khí Y có N2O : x mol và H2 : y mol Có nY = 0,25 = x + y mol Và mY = MY . nY = 13,6.2.0,25 = 6,8 g = 44x + 2y Nên x = 0,15 mol và y = 0,1 mol Xét phản ứng Mg tác dụng với NaNO3 và NaHSO4 thì 4Mg + 10H+ + 2NO3- → 4Mg+2 + 5H2O + N2O Mg +2H+ → Mg+2 + H2 Ta có 4nN2O + nH2 = 4.0,15 + 0,1 = 0,7 mol < nMg = 0,9 nên phản ứng có tạo ra NH4+ : 4Mg + 10H+ + NO3- → 4Mg+2 + 3H2O + NH4+ nên nNH4+ = (0,9 – 0,7 ) : 4 =0,05 mol Bảo toàn nguyên tố N có nNaNO3 = 2nN2O + nNH4 =2.0,15 + 0,05 = 0,35 mol Bảo toàn nguyên tố H có nNaHSO4 = 10nN2O + 2nH2 + 10nNH4 = 10.0,15 + 0,1.2 + 0,05.10 = 2,2 mol Sau phản ứng dung dịch X thu được có Mg+2 : 0,9 mol; NH4+ : 0,05 mol; Na+ : 2,55 mol và SO42- : 2,2 mol => mmuối = mion = 0,9.24 + 0,05.18 + 2,55.23 + 2,2.96 = 292,35
Câu 26 :
Cho các phát biểu sau (1) Thành phần chính của supephotphat kép gồm hai muối Ca(H2PO4)2 và CaSO4 (2) Al là kim loại có tính lưỡng tính (3) Để xử lý thủy ngân rơi vãi, người ta có thể dùng bột lưu huỳnh (4) Khí thoát vào khí quyển, Freon phá hủy tầng ozon (5) Trong khí quyển, nồng độ NO2 và SO2 vượt quá tiêu chuẩn cho phép gây ra hiện tượng mưa axit (6) Đám cháy Mg có thể dập tắt bằng CO2 (7) Phèn chua được dùng để làm trong nước đục (8) Trong tự nhiên, các kim loại kiềm chỉ tồn tại dạng đơn chất Số phát biểu đúng là
Đáp án : B Phương pháp giải :
Dựa vào kiến thức tổng hợp lí thuyết vô cơ Lời giải chi tiết :
(1) sai vì thành phần chính của supephotphat kép là Ca(H2PO4)2 (2) sai vì không có khái niệm kim loại lưỡng tính (3) đúng vì S phản ứng với Hg ở đk thường tạo thành HgS là chất rắn an toàn (4) đúng (5) đúng vì hai chất này là nguyên nhân gây mưa axit (6) sai vì 2Mg + CO2 \(\xrightarrow{{{t^0}}}\) 2MgO + C làm phản ứng cháy tiếp tục (7) đúng, phèn chua có công thức là K2SO4.Al2(SO4)3.24H2O có ứng dụng làm trong nước (8) sai vì trong tự nhiên kim loại kiềm tồn tại dạng hợp chất => có 4 phát biểu đúng
Câu 27 :
Cho các phát biểu sau: (a) mọi este khi xà phòng hóa đều tạo ra muối và ancol (b) Fructozo có nhiều trong mật ong (c) Liên kết của nhóm CO và nhóm NH giữa các aminoaxit là liên kết peptit (d) Amilopectin, tơ tằm, lông cừu là polime thiên nhiên (e) Cao su Buna-S được điều chế bằng phản ứng trùng ngưng (f) Tinh bột và xenlulozo là đồng phân của nhau (g) Protein dạng sợi dễ dàng tan trong nước tạo thành dung dịch keo (h) Amilozo và amylopectin đều có các liên kết α – 1,4 – glicozit Số phát biểu đúng là
Đáp án : C Phương pháp giải :
Dựa vào TCHH của peptit, este và polime Lời giải chi tiết :
(a) sai vì có thể tạo ra andehit, xeton hoặc muối của phenol (b) đúng (c) sai vì liên kết peptit là liên kết giữa nhóm CO và nhóm NH giữa các α aminoaxit (d) đúng (e) sai vì cao su Buna-S được điều chế bằng phản ứng trùng hợp (f) sai vì hệ số n trong CTPT (C6H10O5)n của hai chất khác nhau (g) sai vì protein dạng cầu dễ dàng tan trong nước tạo thành dung dịch keo (h) đúng => có 3 phát biểu đúng
Câu 28 :
Hỗn hợp A gồm hai chất hữu cơ X(đơn chức) và Y( chứa 3 nhóm chức cùng loại) đểu tác dụng với dung dịch NaOH. Để tác dụng với m gam A cần vừa đủ 300 ml dung dịch KOH 1M. Sau khi phản ứng xảy ra hoàn toàn thu được 33,6 gam muối của một axit hữu cơ và 4,6 gam một ancol. Đốt cháy hoàn toàn lượng ancol trên thu được 3,36 lít CO2 (đktc) và 3,6 gam H2O. Tổng số nguyên tử trong một phân tử X gần nhất với số nào sau đây
Đáp án : B Phương pháp giải :
nmuối = nKOH = 0,3 mol => Mmuối = 33,6 : 0,03 =112 (g/mol) Nếu muối là muối tạo từ Y chất có 3 nhóm chức thì muối có M = ? Nếu muối tạo từ X thì muối là ? Lời giải chi tiết :
nmuối = nKOH = 0,3 mol => Mmuối = 33,6 : 0,03 =112 (g/mol) Nếu muối là muối tạo từ Y chất có 3 nhóm chức thì muối có CTPT R(COOK)3 có M> 112( loại) => muối tạo từ chất X đơn chức RCOOK => muối là C2H5COOK => X là C2H5COOH nên X có 11 nguyên tử gần nhất với 10 nguyên tử
Câu 29 :
Hỗn hợp X gồm metan, eten, propin. Nếu cho 13,4 gam hỗn hợp X tác dụng với dd AgNO3/NH3 dư thì thu đươc 14,7 gam kết tủa. Nếu cho 16,8 lít hỗn hợp X (đktc) tác dụng với dung dịch brom thì thấy có 108 gam Br2 phản ứng. Phần trăm thể tích CH4 trong hỗn hợp X là
Đáp án : A Phương pháp giải :
Với dạng bài toán khi thực hiện thí nghiệm mà hỗn hợp các phần không bằng nhau, ta giải bằng cách đặt phần này gấp k lần phần kia. Đặt trong 13,4 gam X đặt số mol CH4, C2H4, C3H4 lần lượt là x,y,z mol Giả sử 16,8 lít X gấp k lần 13,4 gam X => trong 16,8 lít X có số mol các chất lần lượt là xk, yk và zk mol Lập hệ 4 ẩn 4 phương trình với khối lượng X, thể tích X, kết tủa khi phản ứng với AgNO3/NH3; số mol Br2 tham gia phản ứng ta sẽ tìm được x, y, z và k Lời giải chi tiết :
Trong 13,4 gam X đặt số mol CH4, C2H4, C3H4 lần lượt là x,y,z mol Thì trong 16,8 lít X có số mol các chất lần lượt là xk, yk và zk mol X + AgNO3 : C3H4 \(\xrightarrow{{ + AgN{O_3} + N{H_3}}}\) C3H3Ag : z mol → 147z = 14,7 → z =0,1 mol X + Br2 thì C2H4 +Br2 → C2H4Br2 C3H4 + 2Br2 → C3H4Br4 → nBr2 = 0,675 = yk + 2zk Ta có hệ phươn trình sau \(\left\{ \begin{gathered}{m_X} = 16x + 28y + 40z = 13,4 \hfill \\{n_{{C_3}{H_3}Ag}} = z = 0,1 \hfill \\{n_{hhX}} = xk + yk + zk = 0,75 \hfill \\{n_{B{r_2}}} = yk + 2zk = 0,675 \hfill \\\end{gathered} \right. \to \left\{ \begin{gathered}x = 0,15 = {n_{C{H_4}}} \hfill \\y = 0,25 = {n_{{C_2}{H_4}}} \hfill \\z = 0,1 = {n_{{C_3}{H_4}}} \hfill \\k = 1,5 \hfill \\\end{gathered} \right.\) \(\to {V_{C{H_4}}} = \frac{x}{{x + y + z}}.100\% = \frac{{0,15}}{{0,15 + 0,25 + 0,1}}.100\% = 30\% \)
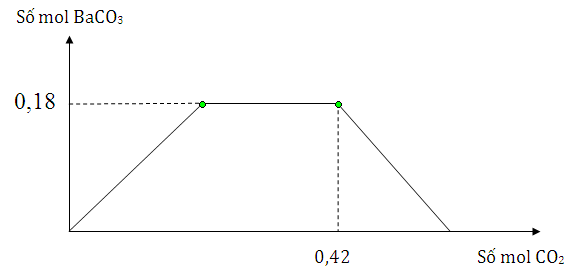
Câu 30 :
Cho m gam hỗn hợp Na và Ba vào nước dư, thu được dung dịch X và V lít khí H2 đktc. Sục khí CO2 từ từ đến dư vào dung dịch X, lượng kết tủa thể hiện trên đồ thị sau Giá trị của m và V lần lượt là
Đáp án : B Phương pháp giải :
PTHH: Na + H2O → NaOH + ½ H2 Ba + 2H2O → Ba(OH)2 + H2 Dd X chứa NaOH và Ba(OH)2 CO2 + OH- → CO32- + H2O CO32- + CO2 +H2O → 2HCO3- Ba2+ + CO32- → BaCO3 Xét đồ thị nBaCO3 max = 0,18 mol → nBa Tại thời điểm CO2 là 0,42 mol thì lượng kết tủa bắt đầu giảm dần → khi đó sản phẩm chỉ có BaCO3 và NaHCO3 → bảo toàn C tính ra NaHCO3 → số mol Na Lời giải chi tiết :
PTHH: Na + H2O → NaOH + ½ H2 Ba + 2H2O → Ba(OH)2 + H2 Dd X chứa NaOH và Ba(OH)2. Cho CO2 vào dung dịch X xảy ra pư CO2 + OH- → CO32- + H2O CO32- + CO2 +H2O → 2HCO3- Ba2+ + CO32- → BaCO3 Xét đồ thị nBaCO3 max = 0,18 mol nên nBa = nBaCO3 max = 0,18 mol Tại thời điểm CO2 là 0,42 mol thì lượng kết tủa bắt đầu giảm dần → khi đó sản phẩm chỉ có BaCO3 : 0,18 mol và NaHCO3 : x mol Bảo toàn C có 0,42 = 0,18 + x nên x = 0,24 mol Bảo toàn Na có nNa ban đầu = nNaHCO3 = 0,24 mol → m = mBa + mNa = 0,18.137 + 0,24.23 = 30,18 g Theo PTHH thì nH2 = ½ . nNa + nBa = ½ . 0,24 + 0,18 = 0,3 mol → V =0,3.22,4 =6,72 lít
Câu 31 :
Este X có đặc điểm sau: - Đốt cháy hoàn toàn X tạo thành CO2 và H2O có số mol bằng nhau - Thủy phân X trong môi trường axit thu được chất Y ( tham gia phản ứng tráng gương) và chất Z (có số nguyên tử cacbon bằng một nửa số cacbon trong X) Có các phát biểu sau : (1) Chất X thuộc loại este no, đơn chức (2) Chất Y tan vô hạn trong nước (3) Đun Z với dung dịch H2SO4 đặc ở 170oC thu được anken (4) Trong điều kiện thường Z ở trạng thái lỏng (5) X có thể hòa tan Cu(OH)2 tạo ra dung dịch màu xanh Số phát biểu đúng là
Đáp án : A Phương pháp giải :
Đốt cháy hoàn toàn X tạo thành CO2 và H2O có số mol bằng nhau nên X là este no đơn chức mạch hở → X là CnH2nO2 - Thủy phân X trong môi trường axit thu được chất Y ( tham gia phản ứng tráng gương) và chất Z (có số nguyên tử cacbon bằng một nửa số cacbon trong X) → Y là HCOOH và Z là CH3OH Lời giải chi tiết :
- Đốt cháy hoàn toàn X tạo thành CO2 và H2O có số mol bằng nhau nên X là este no đơn chức mạch hở → (1) đúng → X là CnH2nO2 - Thủy phân X trong môi trường axit thu được chất Y ( tham gia phản ứng tráng gương) và chất Z (có số nguyên tử cacbon bằng một nửa số cacbon trong X) → Y là HCOOH và Z là CH3OH → X là HCOOCH3 (2) đúng, HCOOH có liên kết hidro nên tan vô hạn trong nước (3) sai, CH3OH không tách nước tạo được anken (4) đúng (5) sai, HCOOCH3 có thể phản ứng được với Cu(OH)2 ở nhiệt độ cao nhưng không tạo ra dung dịch màu xanh lam => có 3 phát biểu đúng
Câu 32 :
Cho các dung dịch sau: Na2CO3; Na2S,CuS, Na2SO4, Fe(NO3)2, FeSO4, Fe(NO3)3 , CH3NH3HCO3, CH3COONa lần lượt vào dung dịch HCl. Số trường hợp có khí thoát ra là
Đáp án : C Phương pháp giải :
Viết các phản ứng xảy ra giữa các chất với HCl, chọn các trường hợp có khí thoát ra. Lời giải chi tiết :
PTHH: 2HCl + Na2CO3 → 2NaCl + H2O + CO2↑ 2HCl + Na2S → NaCl + H2S↑ 12HCl + 9Fe(NO3)2 → 4FeCl3 + 6H2O +3NO↑ + 5Fe(NO3)3 CH3NH3HCO3 + HCl → CH3NH3Cl + H2O + CO2↑ => có 4 thí nghiệm
Câu 33 :
Hòa tan hoàn toàn 192,07 gam hỗn hợp NaHSO4 và Fe(NO3)3 vào nước được dung dịch X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO và Al2O3( trong đó oxi chiếm 30% về khối lượng) tan hết vào X. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch chỉ chứa muối trung hòa và 2,016 lít hỗn hợp khí T có tổng khối lượng 1,84 gam gồm 5 khí đktc, trong đó H2,N2O, NO2 lần lượt có số mol là 0,04; 0,01; 0,01. Cho BaCl2 dư vào Z thu được 356,49 gam kết tủa. Giá trị của m gần nhất với giá trị nào sau đây?
Đáp án : C Phương pháp giải :
T có chứa 5 khí là sản phẩm của phản ứng Y + dung dịch X trong đó có H2; N2O và NO2 nên hai khí còn lại là NO và N2 Đặt T có nN2 = x mol và nNO = y mol thì pt nT (1) Khối lượng của T là mT (2) Giải (1) và (2) có x và y Khi cho Z + BaCl2 thì chỉ xảy ra phản ứng : Ba2+ + SO42- → BaSO4 Bảo toàn nguyên tố S có nNaHSO4 = nBaSO4 = 1,53 mol → mFe(NO3)3 Bảo toàn nguyên tố N có 3nFe(NO3)3 > nNO + 2nN2O + 2nN2 + nNO2 → Phản ứng có tạo thêm NH4+ : nNH4 =? Ta có 4H+ + NO3- + 3e → NO + H2O 10H+ + 2NO3- + 8e → N2O + 5H2O 12H+ + 2NO3- + 10e → N2 +6 H2O 2H+ + NO3- + 1e → NO2 + H2O 10H+ + NO3- + 8e → NH4+ + 3H2O 2H+ +2e → H2 2H+ + O2- → H2O => tính được nO theo PTHH Lời giải chi tiết :
T có chứa 5 khí là sản phẩm của phản ứng Y + dung dịch X trong đó có H2; N2O và NO2 nên hai khí còn lại là NO và N2 Đặt T có nN2 = x mol và nNO = y mol thì nT = 0,09 mol = x + y + 0,04 + 0,01 + 0,01 → x + y =0,03 (1) Khối lượng của T là mT = 28x + 30y + 0,04.2 +0,01.44 + 0,01.46 → 28x + 30y =0,86 (2) Giải (1) và (2) có x = 0,02 mol và y =0,01 mol Vì phản ứng tạo khi H2 nên N+5 phản ứng hết → dung dịch thu được chứa SO42- và các cation khác Khi cho Z + BaCl2 thì chỉ xảy ra phản ứng : Ba2+ + SO42- → BaSO4 → nBaSO4 = 1,53 mol Bảo toàn nguyên tố S có nNaHSO4 = nBaSO4 = 1,53 mol → mFe(NO3)3 = 192,07 – 1,53.120 = 8,47 g nên nFe(NO3)3 = 0,035 mol Bảo toàn nguyên tố N có 3nFe(NO3)3 =0,105 mol nNO + 2nN2O + 2nN2 + nNO2 = 0,01 + 2.0,01+2.0,02 + 0,01 = 0,08 mol < 3nFe(NO3)3 → Phản ứng có tạo thêm NH4+ : nNH4 =0,105 – 0,08 =0,025 mol Ta có 4H+ + NO3- + 3e → NO + H2O 10H+ + 2NO3- + 8e → N2O + 5H2O 12H+ + 2NO3- + 10e → N2 +6 H2O 2H+ + NO3- + 1e → NO2 + H2O 10H+ + NO3- + 8e → NH4+ + 3H2O 2H+ +2e → H2 2H+ + O2- → H2O Vì dung dịch thu được chỉ chứa muối trung hòa nên bảo toàn H có : nNaHSO4 = 4nNO + 10nN2O + 12nN2 + 2nNO2 + 10nNH4 + 2nO + 2nH2 → 1,53 = 4.0,01 + 10.0,01 + 12.0,02 + 2.0,01 + 0,025.10 + 2nO + 2.0,04→ nO = 0,4 mol → mO(Y) = 6,4 g → mY = mO : 30 .100 = 21,33 g → gần nhất với 20g
Câu 34 :
Hỗn hợp X có công thức C12H14O4 . Từ X thực hiện các phản ững sau (a) X + 2NaOH → X1 + 2X2 (b) X1 + H2SO4 → X3 + Na2SO4 (c) nX3 + nX4 → poli(etylen terephtalat) +2nH2O (d) X2 + X3 → X5 + H2O Có các phát biểu sau (1) Khi đốt cháy hoàn toàn 1 mol X1 cho 7 mol CO2 (2) Các chất X1,X2,X3 đều tác dụng với Na (3) Phân tử khối của X5 bằng 222 (4) Các chất X3 và X4 đều là hợp chất đa chức (5) Phản ứng (c) thuộc loại phản ứng trùng hợp (6) Phân tử X5 có 3 liên kết ∏ Số phát biểu đúng là
Đáp án : C Phương pháp giải :
Suy luận theo trình tự: Từ (b) suy ra X3 là axit, X1 là muối của Na Từ (c) suy ra X3 là axit terephtalic C6H4(COOH)2 X4 là etylen glicol C2H4(OH)2 sau đó suy ngược lại phương trình a để tìm được CTCT của X, X2 Từ (d) suy ra được CTCT của X5 Lời giải chi tiết :
Từ (b) suy ra X3 là axit, X1 là muối của Na Từ (c) suy ra X3 là axit terephtalic C6H4(COOH)2 X4 là etylen glicol C2H4(OH)2 (a) H5C2OOC – C6H4 – COOC2H5 + 2NaOH → C6H4(COONa)2 + 2C2H5OH X X1 X2 (b) C6H4(COONa)2 + 2H2SO4 → C6H4(COOH)2 + Na2SO4 X3 (c) nC6H4(COOH)2 + nC2H4(OH)2 → -(O – CH2 –CH2 – O – CO – C6H4 – CO-)-n + 2nH2O X3 X4 (d) C2H5OH + C6H4(COOH)2 → HOOC – C6H4 –COOC2H5 + H2O X2 X3 X5 Có các phát biểu sau (1) Đúng vì C6H4(COONa)2 + 15/2 O2 → 7CO2 + Na2CO3 + 2H2O (2) Sai vì X1 không tác dụng với Na (3) sai vì phân tử khối của X5 bằng 194 (4) đúng (5) sai vì phản ứng (c) thuộc loại phản ứng trùng ngưng (6) sai vì phân tử X5 có 5 liên kết ∏ Số phát biểu đúng là 2
Câu 35 :
X, Y ( MX < MY) là 2 axit kế tiếp thuộc cùng một dãy đồng đẳng axit fomic, Z là este hai chức của X,Y và ancol T. Đốt cháy 25,04 gam hỗn hợp E chứa X, Y, Z, T đều mạch hở cần dùng 16,576 lít khí O2 (đktc) thu được 14,4 gam nước. Mặt khác, đun nóng 12,52 gam E cần dung 380 ml dung dịch NaOH 0,5M. Biết rằng ở điều kiện thường, ancol T không tác dụng được với Cu(OH)2 . Phần trăm khối lượng của X có trong hỗn hợp E gần nhất với :
Đáp án : A Phương pháp giải :
Ta có 25,04 g E + 0,74 mol O2 → 0,8 mol H2O + CO2 Bảo toàn khối lượng có mCO2 → nCO2 < nH2O →E phải chứa ancol T no hai chức Quy đổi hỗn hợp E thành HCOOH : 0,19 mol ( vì nNaOH = nHCOOH) C2H4(OH)2 : a mol CH2 : b mol H2O : c mol Xét 12,52 gam E thì pt mE (1) Khi đốt cháy 12,52 gam E thì HCOOH + ½ O2 → CO2 + H2O C2H4(OH)2 + 5/2 O2 → 2CO2 + 3H2O CH2 + 3/2 O2 → CO2 + H2O Theo PTHH thì pt nO2 (2) và pt nH2O (3) giải (1) (2) và (3) được a , b và c → thực tế trong E có neste = ½. (-c) = 0,02 mol naxit và nancol E có số Ctb → 2 axit Lời giải chi tiết :
Ta có 25,04 g E + 0,74 mol O2 → 0,8 mol H2O + CO2 Bảo toàn khối lượng có mCO2 = mE + mO2 – mH2O =25,04 + 0,74.32 – 14,4 = 34,32 g → nCO2 = 0,78 mol < nH2O →E phải chứa ancol T no hai chức Quy đổi hỗn hợp E thành HCOOH : 0,19 mol ( vì nNaOH = nHCOOH) C2H4(OH)2 : a mol CH2 : b mol H2O : c mol Xét 12,52 gam E thì mE = 0,19.46 + 62a + 14b + 18c = 12,52(1) Khi đốt cháy 12,52 gam E thì HCOOH + ½ O2 → CO2 + H2O C2H4(OH)2 + 5/2 O2 → 2CO2 + 3H2O CH2 + 3/2 O2 → CO2 + H2O Theo PTHH thì nO2 = 0,19.0,5 + 2,5a + 1,5.b = 0,37 mol(2) nH2O = 0,19 + 3a + b + c = 0,4 mol(3) giải (1) (2) và (3) được a = 0,05 mol, b =0,1 mol và c= -0,04 mol → thực tế trong E có neste = ½. (-c) = 0,02 mol naxit = 0,19 – 2.0,02 = 0,15 mol và nancol = a – neste = 0,03 mol E có số Ctb = 0,39 : (0,02 +0,15 + 0,39) = 1,95 → axit có HCOOH và CH3COOH (vì ancol T đa chức nên số C ≥2) Khi đó E là HCOOH : x mol; CH3COOH: (0,15-x) mol; HCOO – CnH2n-COOCH3 : 0,02 mol và CnH2n+2O2 : 0,03 mol → mE = 46x + 60(0,15-x) + 0,02(104+14n) + 0,03.(14n+34) =12,52 → -14x + 0,7n = 0,42 → n = (0,42 + 14x)/0,7 Vì 0 < x < 0,15 mol nên 0,6< n < 3,6 . → Vì T là ancol hai chức không phản ứng với Cu(OH)2 nên T là C3H6(OH)2 → x = 0,12 mol → %HCOOH = 0,12.46 :12,52 .100% = 44,1% → gần nhất 45%
Câu 36 :
Cho sơ đồ phản ứng sau
Số phản ứng oxi hóa khử là
Đáp án : C Phương pháp giải :
Viết phản ứng hóa học xảy ra, các phản ứng có sự thay đổi số oxi hóa của các nguyên tố trước và sau phản ứng là phản ứng oxi hóa khử Lời giải chi tiết :
Ta có sơ đồ sau
Số phản ứng oxi hóa khử là (1); (2); (3);(5);(6) => có 5 phản ứng
Câu 37 :
Hỗn hợp X gồm một axit cacboxylic hai chức, no, mạch hở, hai ancol no đơn chức kế tiếp nhau trong dãy đồng đẳng và một đieste tạo bởi axit và 2 ancol đó. Đốt cháy hoàn toàn 4,84 gam X thu được 7,26 gam CO2 và 2,7 gam nước. Mặt khác, đun nóng 4,84 gam X trên với 80 ml dung dịch NaOH 1M, sau phản ứng xảy ra hoàn toàn thêm vừa đủ 10 ml dung dịch HCl 1M để trung hòa lượng NaOH dư thu được dung dịch Y. Cô cạn dung dịch Y thu được m gam muối khan, đồng thời thu được 896 ml hỗn hợp ancol (ở điều kiện tiêu chuẩn) có tỉ khối hơi so với H2 là 19,5. Giá trị của m gần nhất với số nào sau đây
Đáp án : D Phương pháp giải :
Gọi CTPT trung bình của ancol là R’OH; axit là R(COOH)2; este: R(COOR’)2 với số mol lần lượt là a; b; c Bảo toàn khối lượng : mO2 → nO2 Bảo toàn nguyên tố O: nO(X) → a + 4b + 4c=nO(X) (1) nCOO = nNaOH pứ ⇒ 2b + 2c ⇒ a = ? nancol = 0,04 mol = 2neste + nancol ban đầu ⇒ neste = c = ? ⇒ b = ? Ta có MR’OH = 19,5.2 = 39 g ⇒ MR’ mX = mancol + maxit + meste ⇒ R => dung dịch Y chứa chất gì Lời giải chi tiết :
Gọi CTPT trung bình của ancol là R’OH; axit là R(COOH)2; este: R(COOR’)2 với số mol lần lượt là a; b; c Ta có nCO2 = 0,165 mol; nH2O = 0,15 mol Bảo toàn khối lượng: mX + mO2 = mCO2 + mH2O → mO2 =7,26 + 2,7 – 4,84 = 5,12 → nO2 = 0,16 mol Bảo toàn nguyên tố O: nO(X) + 2nO2 = 2nCO2 + nH2O → nO(X) = 2.0,165 + 0,15 -0,16.2 = 0,16 mol → a + 4b + 4c = 0,16 mol nCOO = nNaOH pứ ⇒ 2b + 2c = 0,08 - 0,01 = 0,07 mol ⇒ a = 0,02 mol nancol = 0,04 mol = 2neste + nancol ban đầu ⇒ neste = c = 0,01 ⇒ b = 0,025 mol Ta có MR’OH = 19,5.2 = 39 g ⇒ MR’ = 22 g mX = mancol + maxit + meste ⇒ 4,84 = 0,02 . 39 + 0,025 .(R + 90) + 0,01. (R + 132) ⇒ R = 14 (CH2) Vậy dung dịch Y gồm 0,01 mol NaCl và 0,035 mol CH2(COONa)2 ⇒ m = 5,765 g gần nhất với 5,7g
Câu 38 :
Cho 7,65 gam hỗn hợp Al và Mg tan hoàn toàn trong 500 ml dung dịch gồm HCl 1,04M và H2SO4 0,28M, thu được dung dịch X và khí H2. Cho 850 ml dung dịch NaOH 1M vào X, sau phản ứng hoàn toàn thu được 16,5 gam kết tủa gồm hai chất. Mặt khác, cho từ từ dung dịch hỗn hợp KOH 0,8M và Ba(OH)2 0,1M vào X đến khi lượng kết tủa lớn nhất, lọc kết tủa đem nung đến khối lượng không đổi, thu được m gam chất rắn. Giá trị của m gần nhất với giá trị nào sau đây
Đáp án : A Phương pháp giải :
Khi thêm 0,85 mol NaOH vào X thì thu được dung dịch chứa NaCl: 0,52 mol và Na2SO4 : 0,14mol; Vì nNaOH > nNaCl + 2nNa2SO4 nên còn NaAlO2→ nNaAlO2 Kết tủa thu được là Mg(OH)2 : x mol và Al(OH)3 : y mol Ta có hệ sau \(\left\{ \begin{gathered}{m_ \downarrow } = 58x + 78y = 16.5 \hfill \\{m_{hh{\text{ bd}}}} = 24x + 27(x + {n_{NaAl{O_2}}}) = 7,65 \hfill \\\end{gathered} \right. \to \left\{ \begin{gathered}x \hfill \\y \hfill \\\end{gathered} \right.\) → dd X có Al+3 ; Mg+2 ; Cl- ; SO42- Ta thấy X có 3nAl + 2nMg < nCl + 2nSO4 nên X có dư H+ → nH+ theo bào toàn điện tích OH- + H+ → H2O OH- + Mg+2 → Mg(OH)2 3OH- + Al+3 → Al(OH)3 Ba2+ + SO42- → BaSO4 Al(OH)3 + OH- → AlO2- + 2H2O Khi thêm 8x mol KOH và x mol Ba(OH)2 vào dung dịch X thì để thu được lượng kết tủa lớn nhất ta xét các TH sau TH1 : kết tủa có tối đa BaSO4 và Mg(OH)2và có thể có Al(OH)3 TH2: Kết tủa có tối đa Al(OH)3 và Mg(OH)2 và có BaSO4 Lời giải chi tiết :
Khi thêm 0,85 mol NaOH vào X thì thu được dung dịch chứa NaCl: 0,52 mol và Na2SO4 : 0,14mol; Vì nNaOH > nNaCl + 2nNa2SO4 nên còn NaAlO2 Bảo toàn Na có nNaOH = nNaCl + 2nNa2SO4 + nNaAlO2 → 0,85 = 0,52 + 2.0,14 + nNaAlO2 → nNaAlO2 = 0,05 mol Kết tủa thu được là Mg(OH)2 : x mol và Al(OH)3 : y mol Ta có hệ sau \(\left\{ \begin{gathered}{m_ \downarrow } = 58x + 78y = 16.5 \hfill \\{m_{hh{\text{ bd}}}} = 24x + 27(x + 0,05) = 7,65 \hfill \\\end{gathered} \right. \to \left\{ \begin{gathered}x = 0,15 \hfill \\y = 0,1 \hfill \\\end{gathered} \right.\) → dd X có Al+3 : 0,15 mol; Mg+2 : 0,15 mol; Cl- : 0,52 mol; SO42- : 0,14 mol Ta thấy X có 3nAl + 2nMg < nCl + 2nSO4 nên X có dư H+ → nH+ = 0,52 + 0,14.2 -0,15.3 -0,15.2 = 0,05 mol OH- + H+ → H2O OH- + Mg+2 → Mg(OH)2 3OH- + Al+3 → Al(OH)3 Ba2+ + SO42- → BaSO4 Al(OH)3 + OH- → AlO2- + 2H2O Khi thêm 8x mol KOH và x mol Ba(OH)2 vào dung dịch X thì để thu được lượng kết tủa lớn nhất ta xét các TH sau TH1 : kết tủa có BaSO4 : 0,14 mol và Mg(OH)2: 0,15 mol và có thể có Al(OH)3 Bảo toàn Ba có x = 0,14 mol → nOH =8x + 2x =10x =1,4 mol > 2nMg + 4nAl +nH+ = 0,95 → phản ứng có kết tủa Al(OH)3 bị hòa tan hết → kết tủa thu được là BaSO4 và Mg(OH)2 → đem nung thu được BaSO4 : 0,14 mol và MgO : 0,15 mol → m = 38,62g TH2: Kết tủa có Al(OH)3 : 0,15 mol và Mg(OH)2: 0,15 mol; BaSO4 Ta có nOH = 10x = 0,15.3 + 0,15.2 +0,05=0,8 → x = 0,08 mol→ có 0,08 mol BaSO4 → Đem nhiệt phân thu được 0,08 mol BaSO4; 0,075 mol Al2O3 và 0,15mol MgO → m = 0,08.233 + 0,075.102 +0,15.40 =32,29g Nên TH1 khối lượng kết tủa lớn nhất là 38,62 g gần nhất với 38,6 nhất
Câu 39 :
X là este của aminoaxit; Y và Z là hai peptit(MY < MZ, hơn kém nhau một nguyên tử nito trong phân tử). X,Y và Z đều mạch hở. Cho 60,17 gam hỗn hợp E gồm X, Y, Z tác dụng vừa đủ với 0,73 mol NaOH, sau phản ứng thu được 73,75 gam ba muối của glyxin, alanin và valin( trong đó có 0,15 mol muối alanin)và 14,72 gam ancol no, đơn chức, mạch hở. Mặt khác, đốt cháy 60,17 gam E trong O2 dư thu được CO2, N2 và 2,275 mol H2O. Phần trăm khối lượng của Y trong E có giá trị gần nhất là
Đáp án : D Phương pháp giải :
Gọi số mol của Gly và Val lần lượt là x và y mol Ta có nNaOH =nGly + nVal + nAla => pt (1) mmuối = pt(2) giải (1) và (2) có x và y Xét phản ứng E + NaOH : 60,17 g E + 0,73mol NaOH → 73,75 g muối + 14,72 g ancol và H2O Bảo toàn khối lượng có mH2O nên nY + nZ = nH2O = 0,05 mol Xét phản ứng E + O2 → CO2 + H2O + N2 Quy đổi E \(\left\{ \begin{gathered}NH - C{H_2}CO:0,73 \\C{H_2}:0,15 + 0,02.3 = 0,21 \\{H_2}O:0,05 \\{C_n}{H_{2n + 2}}O:a{\text{ mol}}(14,72g)\\\end{gathered} \right.\) + O2 → 2,275 mol H2O Bảo toàn H có 0,73.3 + 0,21.2 + 0,05.2 + (2n+2)a =2,275.2 Và 14,72 = a(14n + 34) → ancol là CH3OH → nX theo nancol naa tạo từ Y và Z = 0,73 – nX → số aa trung bình của Y và Z là naa tạo từ Y và Z : nY và Z = 5,4 Mà Y và Z hơn kém nhau 1N nên Y là pentapeptit còn Z là hexapeptit Lời giải chi tiết :
Gọi số mol của Gly và Val lần lượt là x và y mol Ta có nNaOH =nGly + nVal + nAla => 0,73 = x + y + 0,15 (1) mmuối = 73,75 = (75+22)x + (117+ 22)y + 0,15(89+22) (2) giải (1) và (2) có x = 0,56 mol và y =0,02 mol Xét phản ứng E + NaOH : 60,17 g E + 0,73mol NaOH → 73,75 g muối + 14,72 g ancol và H2O Bảo toàn khối lượng có mH2O = 60,17 + 0,73.40 – 73,75-14,72 = 0,9 nên nH2O = 0,05 mol => nY + nZ = nH2O = 0,05 mol Xét phản ứng E + O2 → CO2 + H2O + N2 \(\left\{ \begin{gathered}NH - C{H_2}CO:0,73 \\C{H_2}:0,15 + 0,02.3 = 0,21 \\{H_2}O:0,05 \\{C_n}{H_{2n + 2}}O:a{\text{ mol}}(14,72g) \\\end{gathered} \right.\) + O2 → 2,275 mol H2O
Bảo toàn H có 0,73.3 + 0,21.2 + 0,05.2 + (2n+2)a =2,275.2 Và 14,72 = a(14n + 34) nên an =0,46 và a = 0,46 suy ra n = 1→ ancol là CH3OH : 0,46 mol → nX = 0,46 mol → X tạo từ Gly vào CH3OH (vì chỉ có nGly > 0,46) naa tạo từ Y và Z = 0,73 – 0,46 =0,27 mol → số aa trung bình của Y và Z là 0,27 : 0,05 = 5,4 Mà Y và Z hơn kém nhau 1N nên Y là pentapeptit còn Z là hexapeptit Ta có hệ sau \(\left\{ \begin{gathered}{n_Y} + {n_Z} = 0,05 \\5{n_Y} + 6{n_Z} = 0,27 \\\end{gathered} \right. \to \left\{ \begin{gathered}{n_Y} = 0,03 \\{n_Z} = 0,02 \\\end{gathered} \right.\) Y và Z được cấu tạo từ 0,15 mol Ala, 0,1 mol Gly và 0,02 mol Val Y là (Ala)3 – (Gly)2 và Z là Val- (Ala)3 – (Gly)2 Nên %Y = $\frac{{0,03.345}}{{60,17}}.100\% = 17,2\% $ gần nhất với 17,8%
Câu 40 :
Điện phân dung dịch X chứa a mol Cu(NO3)2 và 0,2 mol NaCl (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) trong thời gian t giây, thu được 3,36 lít khí ở anot( đktc) và dung dịch Y. Nếu thời gian điện phân là 2t giây thì tổng thể tích khí thu được ở cả 2 điện cực là 7,84 lít (đktc). Cho dung dịch Y phản ứng tối đa với m gam Fe tạo ra khí NO(sản phẩm khử duy nhất). Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của m là
Đáp án : B Phương pháp giải :
Khi điện phân t giây thì nkhí(A) = 0,15 mol > ½ nCl nên khi này đã xảy ra cả điện phân nước Tại A : 2Cl- → Cl2 + 2e 2H2O → 4H+ + O2 + 4e => ne trao đổi = 2nCl2 + 4nO2 Khi điện phân 2t giây thì ne trao đổi Tại A : nCl2 = 0,1 và nO2 = ? Tại K : Cu+2 + 2e → Cu 2 H2O + 2e → 2OH- + H2 Số mol khí thoát ra ở cả hai cực là nkhí → nH2 Tại K thì ne trao đổi = 2nCu + 2nH2 => nCu = 0,3 mol => Dung dịch Y thu được sau điện phân t giây có Na+ : 0,2 mol; NO3- : ? và H+ : ? ; Cu2+ :? Y + Fe thì 3Fe + 8H+ +2NO3- → 3Fe+2 + 4H2O + 2NO Fe + Cu2+ → Fe2+ +Cu Lời giải chi tiết :
Khi điện phân t giây thì nkhí(A) = 0,15 mol > ½ nCl nên khi này đã xảy ra cả điện phân nước Tại A : 2Cl- → Cl2 + 2e 2H2O → 4H+ + O2 + 4e Ta có nCl2 = ½ .nCl = 0,1 mol nên nO2 = nkhí - nCl2 = 0,15 -0,1 =0,05 mol => ne trao đổi = 2nCl2 + 4nO2 = 2.0,1 + 4.0,05 = 0,4 mol Khi điện phân 2t giây thì ne trao đổi = 0,4.2 = 0,8 mol Tại A : 2Cl- → Cl2 + 2e 2H2O → 4H+ + O2 + 4e Nên có 0,1 mol khí Cl2 và có 0,15 mol O2 Tại K : Cu+2 + 2e → Cu 2 H2O + 2e → 2OH- + H2 Số mol khí thoát ra ở cả hai cực là nkhí =7,84 : 22,4 = 0,35 = 0,1 + 0,15 + nH2 → nH2 = 0,1mol Tại K thì ne trao đổi = 0,8 = 2nCu + 2nH2 = 2nCu + 2.0,1 => nCu = 0,3 mol => a =0,3 mol => tại thời điểm t giây thì nCu(2+) bị điện phân = 0,4:2 =0,2 mol Dung dịch Y thu được sau điện phân t giây có Na+ : 0,2 mol; NO3- : 0,6 mol và H+ : 0,2 mol; Cu2+ :0,1 mol Y + Fe thì 3Fe + 8H+ +2NO3- → 3Fe+2 + 4H2O + 2NO => Phản ứng có H+ hết nên tính theo H+ => nFe phản ứng = 3/8 . nH+ = 3: 8 . 0,2 = 0,075 mol Fe + Cu2+ → Fe2+ +Cu => mFe = m = (0,075+0,1).56 = 9,8g |