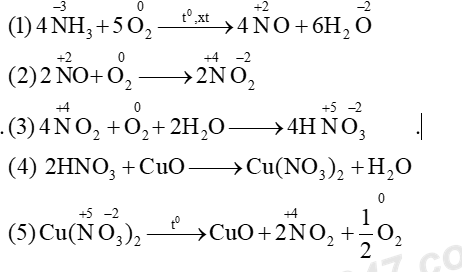Đề thi thử THPT QG môn Hóa trường THPT Nguyễn Quang Diệu - Đồng ThápĐề bài
Câu 1 :
Dung dịch trong nước của chất nào dưới đây có màu da cam?
Câu 2 :
Kim loại vừa phản ứng với dung dịch HCl, vừa phản ứng với dung dịch NaOH là
Câu 3 :
Công thức hóa học của sắt (III) oxit là
Câu 4 :
Từ xenlulozo có thể chế hóa ra sản phẩm nào sau đây?
Câu 5 :
Cho các chất sau: tristearin, tinh bột, etyl axetat, tripeptit (Gly - Ala - Val). Số chất tham gia phản ứng thủy phân trong môi trường kiềm là
Câu 6 :
Kim loại không phản ứng với dung dịch HCl là
Câu 7 :
Thuốc thử dùng để phân biệt 3 dung dịch riêng biệt NaCl, NaHSO4, HCl là
Câu 8 :
Cho 3,36 lít khí CO (đktc) phản ứng vừa đủ với 20 gam hỗn hợp X gồm CuO và MgO. Phần trăm khối lượng của MgO trong X là
Câu 9 :
Lên men 90 gam glucozo thành ancol etylic với hiệu suất 70%, thu được V lít khí CO2 (đktc). giá trị của V là
Câu 10 :
Khi nấu canh cua thấy các màng "gạch cua" nổi lên là do
Câu 11 :
Tơ nào sau đây thuộc tơ tổng hợp?
Câu 12 :
Dung dịch có pH > 7 là
Câu 13 :
Xà phòng hóa hoàn toàn triglyxerit X trong dung dịch NaOH vừa đủ, thu được glyxerol, natri oleat (a mol) và natri panmitat (2a mol). Phân tử khối của X (theo đvC) là
Câu 14 :
Chất nào dưới đây tạo kết tủa trắng với dung dịch brom?
Câu 15 :
Cho dung dịch NaOH vào dung dịch chất X, thu được kết tủa màu trắng không tan trong NaOH dư. Chất X là
Câu 16 :
Este nào sau đây làm mất mất màu dung dịch Br2 ở điều kiện thường?
Câu 17 :
Cho các nhận định sau: (a) Ở điều kiện thường, trimetylamin là chất lỏng, tan tốt trong nước. (b) Ở trạng thái kết tinh, các amino axit tồn tại dưới dạng ion lưỡng cực. (c) Polipeptit gồm các peptit có từ 2 đến 10 gốc α - aminoaxit và là cơ sở tạo nên protein. (d) Dung dịch anilin trong nước làm xanh quỳ tím. Số nhận định đúng là
Câu 18 :
Cho các phát biểu sau: (a) Điện phân dung dịch NaCl (điện cực trơ, có màng ngăn), thu được khí H2 ở anot. (b) Cho a mol bột Fe vào lượng dư dung dịch AgNO3 (phản ứng hoàn toàn), thu được 2a mol Ag. (c) Nhúng thanh Zn vào dung dịch chứa CuSO4 và H2SO4 thì Zn bị ăn mòn điện hóa. (d) Cho dung dịch FeCl3 vào lượng dư dung dịch AgNO3 (phản ứng hoàn toàn), thu được kết tủa gồm AgCl và Ag. Số phát biểu đúng là
Câu 19 :
Cho sơ đồ phản ứng sau: \(N{H_3}\xrightarrow[{{t^0},xt}]{{ + {O_2}}}NO\xrightarrow{{ + {O_2}}}N{O_2}\xrightarrow{{ + {O_2} + {H_2}O}}HN{O_3}\xrightarrow{{ + CuO}}Cu{(N{O_3})_2}\xrightarrow{{{t^0}}}N{O_2}\) Mỗi mũi tên là một phản ứng hóa học. Số phản ứng oxi hóa - khử trong chuỗi trên là
Câu 20 :
Phát biểu nào sau đây không đúng?
Câu 21 :
Cho các phản ứng sau: (a) NaOH + HClO → NaClO + H2O (b) Mg(OH)2 + 2HCl → MgCl2 + 2H2O (b) 3KOH + H3PO4 → K3PO4 + 3H2O (d) Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O Số phản ứng có cùng phương trình in rút gọn: H+ + OH- → H2O là
Câu 22 :
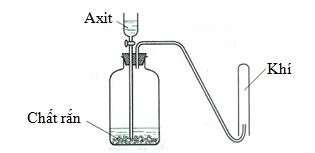
Cho hình vẽ mô tả thí nghiệm điều chế khí X khi cho dung dịch axit tác dụng với chất rắn (kim loại hoặc muối). Hình vẽ dưới minh họa phản ứng nào sau đây?
Câu 23 :
Cho 21,9 gam lysin tác dụng hoàn toàn với dung dịch NaOH dư thu được m gam muối. Giá trị của m là
Câu 24 :
Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 (loãng, dư), thu được dung dịch X. Cho dãy gồm các chất: Fe, KNO3, KMnO4, BaCl2, NaOH, Cu. Số chất trong dãy phản ứng được với dung dịch X là
Câu 25 :
Cho m gam hỗn hợp X gồm ba este (chỉ chứa este, không có chức khác) tác dụng tối đa với 525 ml dung dịch NaOH 1M, thu được hỗn hợp Y gồm 2 ancol đơn chức cùng dãy đồng đẳng và 42,9 gam hỗn hợp muối Z. Đốt cháy hoàn toàn Y, thu được 6,72 lít khí CO2(đktc) và 9,45 gam H2O. Giá trị của m là
Câu 26 :
Để hòa tan hết 5,46 gam Fe cần ít nhất V (ml) dung dịch hỗn hợp H2SO4 0,3M và Fe(NO3)3 0,04M. Biết(sản phẩm khử N+5 là NO duy nhất). Giá trị của V là
Câu 27 :
Thực hiện các thí nghiệm sau đến phản ứng xảy ra hoàn toàn: (a) Dẫn a mol khí CO2 vào 0,8a mol Ca(OH)2 trong dung dịch. (b) Cho a mol Fe vào 3a mol HNO3 trong dung dịch (sản phẩm khử duy nhất tạo ra là NO) (c) Cho dung dịch NaHCO3 đến dư vào dung dịch Ba(OH)2. (d) Cho bột Cu vào dung dịch FeCl3 (dư) Số thí nghiệm thu được dung dịch chứa hai muối là
Câu 28 :
Cho 26,03 gam Ba vào 100 ml dung dịch chứa Al2(SO4)3 0,5M đến khi phản ứng hoàn toàn, thu được m gam kết tủa. Phát biểu nào sau đây đúng?
Câu 29 :
Tiến hành thí nghiệm với các chất X, Y, Z (trong dung dịch) thu được các kết quả như sau:
Câu 30 :
Đốt cháy hoàn toàn 0,08 mol hỗn hợp X gồm (C2H2, C2H4, CH4 và C3H6), thu được 0,14 mol CO2 và 0,17 mol H2O. Mặt khác, cho 2,525 gam X phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
Câu 31 :
Hỗn hợp X gồm glyxin, valin, lysin và axit glutamic (trong X tỉ lệ khối lượng của nito và oxi là 7:15). Cho 7,42 gam X tác dụng vừa đủ với dung dịch HCl, thu được dung dịch Y. Dung dịch Y tác dụng vừa đủ dung dịch chứa 0,08 mol NaOH và 0,075 mol KOH, cô cạn dung dịch sau phản ứng, thu được m gam muối khan. Giá trị m là
Câu 32 :
Điện phân (với điện cực trơ, màng ngăn) dung dịch chứa hỗn hợp CuSO4 và NaCl (trong đó số mol NaCl gấp 4 lần số mol CuSO4) bằng dòng điện một chiều có cường độ ổn định. Sau t (h), thu được dung dịch X và sau 2t (h), thu được dung dịch Y. Dung dịch X tác dụng với bột Al dư, thu được 1,5a mol khí H2. Dung dịch Y tác dụng với bột Al dư, thu được 12a mol khí H2. Biết hiệu suất điện phân 100%, các phản ứng xảy ra hoàn toàn, các khí sinh ra không hòa tan vào nước. Phát biểu nào dưới đây đúng?
Câu 33 :
Hỗn hợp E gồm ba este X, Y, Z (đều mạch hở, chỉ chứa một loại nhóm chức; trong phân tử mỗi este có số liên kết π không quá 3; MX < MY < MZ; X chiếm 50% số mol hỗn hợp). Đun nóng 11,14 gam E với dung dịch NaOH vừa đủ, thu được hỗn hợp T gồm các muối và hỗn hợp G chứa ba ancol đều no. Tỉ khối hơi của G so với H2 bằng 28,75. Đốt cháy toàn bộ T cần dùng 0,115 mol O2, thu được 9,805 gam Na2CO3 và 0,215 mol hỗn hợp gồm CO2 và H2O. Phần trăm khối lượng của Y trong E là
Câu 34 :
Hỗn hợp E gồm X (C7H16O6N2) và Y (C5H14O4N2, là muối của axit cacboxylic hai chức) tác dụng hoàn toàn với dung dịch KOH, thu được ancol etylic, hai amin no (đơn chức, kế tiếp trong dãy đồng đẳng, có tỉ khối hơi so với khí hidro bằng 16,9) và dung dịch Z. Cô cạn dung dịch Z, thu được hỗn hợp T gồm 2 muối khan có cùng số nguyên tử cacbon trong phân tử (trong đó có 1 muối của axit cacboxylic và 1 muối của α-amino axit). Phần trăm khối lượng của muối có phân tử khối nhỏ hơn trong T là
Câu 35 :
Cho các phát biểu sau: (a) Thép là hợp kim của sắt với cacbon và một số nguyên tố khác, trong đó có từ 0,01-2% khối lượng cacbon. (b) Bột nhôm trộn với bột Fe2O3 dùng để hàn đường ray bằng phản ứng nhiệt nhôm. (c) Phèn chua và thạch cao sống có công thức hóa học lần lượt là KAl(SO4)2.12H2O và CaSO4.2H2O. (d) Thạch cao nung dùng để nặn tượng, bó bột khi gãy xương. (e) Dung dịch Na2CO3, Na3PO4 làm mềm được nước cứng. (g) Miếng gang để trong không khí ẩm xảy ra ăn mòn điện hóa. Số phát biểu đúng là
Câu 36 :
Peptit X mạch hở được cấu tạo từ hai loại α-amino axit A, B (đều no, mạch hở, đều chứa một nhóm -NH2). Biết X tác dụng hoàn toàn với dung dịch NaOH theo phản ứng sau: X + 11NaOH → 3A + 4B + 5H2O Đốt cháy hoàn toàn a mol X thu được hỗn hợp gồm N2, H2O và 29a mol CO2. Hỗn hợp các peptit mạch hở E gồm tripeptit A2B, tetrapeptit A2B2, pentapeptit A2B3 và đipeptit A-A. Đốt cháy hết b gam E trong oxi thu được N2, 0,5625 mol H2O và 0,675 mol CO2. Mặt khác, cho 0,15 mol E tác dụng hết với dung dịch NaOH dư, đun nóng sau khi phản ứng xảy ra hoàn toàn, cô cạn dung dịch, thu được chất rắn khan chứa c gam muối. Giá trị của c gần nhất với
Câu 37 :
Hòa tan hết m gam hỗn hợp gồm Na, Na2O, Ba, BaO vào nước, thu được 0,06 mol khí H2 và dung dịch X. Hấp thụ hết 0,128 mol khí CO2 vào dung dịch X, thu được dung dịch Y (chỉ chứa các muối) và kết tủa Z. Chia dung dịch Y làm 2 phần bằng nhau: + Cho từ từ phần 1 vào 200 ml dung dịch HCl 0,24M thấy thoát ra 0,03 mol khí CO2. + Nếu cho từ từ 200 ml dung dịch HCl 0,24M vào phần 2 thấy thoát ra 0,024 mol khí CO2. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
Câu 38 :
Cho 1 mol chất X (C7HyO3, chứa vòng benzen) tác dụng hết với NaOH dư, thu được 1 mol chất Y, 1 mol chất Z và 2 mol H2O (trong đó MY < MZ; có 3 mol NaOH tham gia phản ứng). Chất Z tác dụng với dung dịch H2SO4 loãng dư thu được T (Y, Z, T là các hợp chất hữu cơ). Phát biểu nào sau đây sai?
Câu 39 :
Cho 11,2 gam hỗn hợp X gồm Fe, FeO, Fe2O3, CuO vào dung dịch HCl, thu được chất rắn Y (chỉ chứa một kim loại), dung dịch Z (chỉ chứa muối) và 448 ml H2 (đktc). Cho lượng Y này phản ứng với dung dịch HNO3 (dư) đậm đặc, nung nóng, thu được 896 ml khí NO2 (đktc, sản phẩm khử duy nhất của N+5). Cho dung dịch Z trên vào dung dịch AgNO3 dư, thu được 53,14 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Khối lượng của CuO trong X là
Lời giải và đáp án
Câu 1 :
Dung dịch trong nước của chất nào dưới đây có màu da cam?
Đáp án : A Phương pháp giải :
Dựa vào màu sắc của các muối đac được học, từ đó chọn được muối có màu da cam tương ứng Lời giải chi tiết :
A. dung dịch K2Cr2O7 có màu da cam B. dung dich KCl không có màu C. dung dich K2CrO4 có màu vàng. D. dung dich KMnO4 có màu tím
Câu 2 :
Kim loại vừa phản ứng với dung dịch HCl, vừa phản ứng với dung dịch NaOH là
Đáp án : C Phương pháp giải :
Dựa vào tính chất hóa học của các kim loại Al, Fe, Cr, Cu đã được học để chọn ra kim loại phù hợp với yêu cầu. Lời giải chi tiết :
Al vừa phản ứng được với dd HCl và dd NaOH 3Al + 6HCl → 2AlCl3 + 3H2↑ Al + NaOH + H2O → NaAlO2 + 3/2H2↑
Câu 3 :
Công thức hóa học của sắt (III) oxit là
Đáp án : B Lời giải chi tiết :
Công thức hóa học của sắt (III) oxit là Fe2O3
Câu 4 :
Từ xenlulozo có thể chế hóa ra sản phẩm nào sau đây?
Đáp án : D Phương pháp giải :
Dựa vào tính chất hóa học và ứng dụng của xenlulozo Lời giải chi tiết :
Từ xenlulozo có thể chế hóa ra sản phẩm là thuốc sung không khói.
Câu 5 :
Cho các chất sau: tristearin, tinh bột, etyl axetat, tripeptit (Gly - Ala - Val). Số chất tham gia phản ứng thủy phân trong môi trường kiềm là
Đáp án : A Phương pháp giải :
các chất có các nhóm -COO; -CO-NH dễ bị thủy phân trong môi trường kiềm Lời giải chi tiết :
Các chất tham gia phản ứng thủy phân trong môi trường kiềm là: tristearin, etyl axetat, tripeptit (Gly - Ala - Val) => có 3 chất
Câu 6 :
Kim loại không phản ứng với dung dịch HCl là
Đáp án : C Phương pháp giải :
Kim loại đứng sau H trong dãy điện hóa học của kim loại sẽ không phản ứng được với dd HCl Lời giải chi tiết :
Cu không phản ứng được với dd HCl vì đứng sau H trong dãy điện hóa
Câu 7 :
Thuốc thử dùng để phân biệt 3 dung dịch riêng biệt NaCl, NaHSO4, HCl là
Đáp án : C Phương pháp giải :
chọn thuốc thử mà khi cho vào các chất trên ta quan sát được các hiện tượng rõ ràng như: có khí thoát ra hay không, có kết tủa hay không, sự thay đổi màu sắc,.... Lời giải chi tiết :
Dùng BaCO3 để phân biệt NaCl, NaHSO4, HCl vì Khi cho BaCO3 lần lượt vào các dụng dịch trên + dung dịch BaCO3 không tan là NaCl + dung dịch BaCO3 tan tạo khí đồng thời có xuất hiện kết tủa trắng là NaHSO4 2NaHSO4 + BaCO3 → BaSO4↓trắng + Na2SO4 + CO2↑ + H2O + dung dịch BaCO3 tan và có khí thoát ra là HCl 2HCl + BaCO3 → BaCl2 + CO2↑ + H2O
Câu 8 :
Cho 3,36 lít khí CO (đktc) phản ứng vừa đủ với 20 gam hỗn hợp X gồm CuO và MgO. Phần trăm khối lượng của MgO trong X là
Đáp án : D Phương pháp giải :
Khi cho CO qua hỗn hợp CuO và MgO chỉ có CuO phản ứng. Viết PTHH xảy ra, tính mol CuO theo mol CO, từ đó tính được % CuO và suy ra được %MgO còn lại. Lời giải chi tiết :
nCO(đktc) = 3,36 :22,4 = 0,15 (mol) Khi cho CO qua hỗn hợp CuO và MgO chỉ có CuO phản ứng CO + CuO \(\xrightarrow{{{t^0}}}\) Cu + H2O 0,15 → 0,15 (mol) nCuO = 0,15 (mol) => mCuO = 0,15.80 = 12 (g) %CuO = (mCuO : mhh).100% = (12 : 20).100% = 60% => %MgO = 100% -%CuO = 40%.
Câu 9 :
Lên men 90 gam glucozo thành ancol etylic với hiệu suất 70%, thu được V lít khí CO2 (đktc). giá trị của V là
Đáp án : A Phương pháp giải :
Đổi số mol của glucozo, vì %H = 70% suy ra được mol glu phản ứng C6H12O6 \(\xrightarrow({len\,men}){{{t^0}}}\) 2C2H5OH + 2CO2 Tính mol CO2 theo mol glu phản ứng, từ đó tính được VCO2(đktc) = ? Lời giải chi tiết :
nGlu = 90 :180 = 0,5 (mol) Vì %H = 70% nên số mol glucozo tham gia phản ứng là: nGlu pư = nglu bđ. %H = 0,5.0,7 = 0,35 (mol) C6H12O6 \(\xrightarrow({len\,men}){{{t^0}}}\) 2C2H5OH + 2CO2 0,35 → 0,7 (mol) => nCO2 = 0,7 (mol) => VCO2(đktc) = 0,7.22,4 = 15,68 (l)
Câu 10 :
Khi nấu canh cua thấy các màng "gạch cua" nổi lên là do
Đáp án : B Phương pháp giải :
Dựa vào thành phần chính của gạch cua là gì, từ đó chọn được tính chất phù hợp của hiện tượng này Lời giải chi tiết :
gạch cua có thành phần chính là protein, mà tính chất của protein là khi gặp nhiệt độ cao sẽ bị đông tụ lại => gạch cua nổi là do sự đông tụ protein.
Câu 11 :
Tơ nào sau đây thuộc tơ tổng hợp?
Đáp án : C Phương pháp giải :
Dựa vào sự phân loại của các tơ: tơ thiên nhiên (100% từ thiên nhiên), tơ bán tổng hợp (một phần từ thiên nhiên và 1 phần do con người tạo ra), tơ tổng hợp (100% do con người tạo ra). Từ đó chọn được tơ phù hợp. Lời giải chi tiết :
Tơ xenlulozơ, tơ visco là tơ bán tổng hợp tơ olon là tơ tổng hợp tơ tằm là tơ thiên nhiên
Câu 12 :
Dung dịch có pH > 7 là
Đáp án : D Phương pháp giải :
pH > 7 => chọn dung dịch có môi trường bazo Lời giải chi tiết :
pH > 7 => dung dịch có môi trường bazo => đó là dd NH3
Câu 13 :
Xà phòng hóa hoàn toàn triglyxerit X trong dung dịch NaOH vừa đủ, thu được glyxerol, natri oleat (a mol) và natri panmitat (2a mol). Phân tử khối của X (theo đvC) là
Đáp án : A Phương pháp giải :
X được tạo bởi 1 gốc axit C17H35COOH và 2 gốc axit C15H31COOH với glixerol. Từ đó viết CTCT của X và tính được phân tử khối Lời giải chi tiết :
triglyxerit X + 3NaOH → C17H33COONa + C15H31COONa + C3H5(OH)3 a (mol) a (mol) 2a (mol) => X được tạo bởi 1 gốc axit C17H33COOH và 2 gốc axit C15H31COOH với glixerol => Phân tử khối của X là 832
Câu 14 :
Chất nào dưới đây tạo kết tủa trắng với dung dịch brom?
Đáp án : D Phương pháp giải :
Xem lại lý thuyết về este và amin Lời giải chi tiết :
Chất tạo kết tủa trắng với dd Br2 là anilin
Câu 15 :
Cho dung dịch NaOH vào dung dịch chất X, thu được kết tủa màu trắng không tan trong NaOH dư. Chất X là
Đáp án : B Phương pháp giải :
Dựa vào màu sắc kết tủa của các hidroxit và tính tan của nó trong NaOH Lời giải chi tiết :
3NaOH + FeCl3 → Fe(OH)3↓ (nâu đỏ) + 3NaCl 2NaOH + MgCl2 → Mg(OH)2↓ (trắng) + 2NaCl 2NaOH + CuCl2 → Cu(OH)2↓ (xanh) + 2NaCl 3NaOH + AlCl3 → Al(OH)3↓ (trắng) + 3NaCl => có Mg(OH)2 và Al(OH)3 kết tủa trắng nhưng Al(OH)3 tan được trong NaOH dư. Do vậy dd X là MgCl2
Câu 16 :
Este nào sau đây làm mất mất màu dung dịch Br2 ở điều kiện thường?
Đáp án : D Phương pháp giải :
Chất có liên kết bội C=C hoặc C≡C trong phân tử, hoặc nhóm -CHO thì làm mất màu dung dịch nước brom ở điều kiện thường Lời giải chi tiết :
metyl acrylat làm mất màu dd Br2 ở đk thường. CH2=CH-COOCH3 + Br2 → CH2Br - CHBr-COOCH3
Câu 17 :
Cho các nhận định sau: (a) Ở điều kiện thường, trimetylamin là chất lỏng, tan tốt trong nước. (b) Ở trạng thái kết tinh, các amino axit tồn tại dưới dạng ion lưỡng cực. (c) Polipeptit gồm các peptit có từ 2 đến 10 gốc α - aminoaxit và là cơ sở tạo nên protein. (d) Dung dịch anilin trong nước làm xanh quỳ tím. Số nhận định đúng là
Đáp án : A Phương pháp giải :
Dựa vào kiến thức học về amin, aminoaxit, peptit - protein. Lời giải chi tiết :
(a) sai, điều kiện thường, trimetylamin là chất khí. (b) đúng (c) sai, oligopeptit mới gồm các peptit có từ 2 đến 10 gốc α - aminoaxit và là cơ sở tạo nên protein. (d) sai, vì tính bazo của anilin rất yếu nên không làm đổi màu giấy quỳ tím => có 1 nhận định đúng
Câu 18 :
Cho các phát biểu sau: (a) Điện phân dung dịch NaCl (điện cực trơ, có màng ngăn), thu được khí H2 ở anot. (b) Cho a mol bột Fe vào lượng dư dung dịch AgNO3 (phản ứng hoàn toàn), thu được 2a mol Ag. (c) Nhúng thanh Zn vào dung dịch chứa CuSO4 và H2SO4 thì Zn bị ăn mòn điện hóa. (d) Cho dung dịch FeCl3 vào lượng dư dung dịch AgNO3 (phản ứng hoàn toàn), thu được kết tủa gồm AgCl và Ag. Số phát biểu đúng là
Đáp án : B Phương pháp giải :
Viết lần lượt các phản ứng hóa học của các phản ứng ở các phần ra, kết luận xem phát biểu đó đúng hay sai.
Lời giải chi tiết :
(a) sai, H2 thu được tại catot (b) sai, a mol Fe thu được 3a mol Ag. Fe + 3AgNO3 dư → Fe(NO3)3 + 3Ag↓ (c) đúng (d) sai, kết tủa chỉ thu được AgCl => có 1 phát biểu đúng
Câu 19 :
Cho sơ đồ phản ứng sau: \(N{H_3}\xrightarrow[{{t^0},xt}]{{ + {O_2}}}NO\xrightarrow{{ + {O_2}}}N{O_2}\xrightarrow{{ + {O_2} + {H_2}O}}HN{O_3}\xrightarrow{{ + CuO}}Cu{(N{O_3})_2}\xrightarrow{{{t^0}}}N{O_2}\) Mỗi mũi tên là một phản ứng hóa học. Số phản ứng oxi hóa - khử trong chuỗi trên là
Đáp án : B Phương pháp giải :
Viết các phản ứng hóa học xảy ra, các phản ứng có sự thay đổi số oxi của các nguyên tố trước và sau phản ứng thì đó là phản ứng oxi hóa khử. Lời giải chi tiết :
=> các phương trình (1), (2), (3) , (5) đều là phản ứng oxi hóa khử => có 4 phản ứng oxh - khử
Câu 20 :
Phát biểu nào sau đây không đúng?
Đáp án : C Phương pháp giải :
Dựa vào tính chất được học về crom và hợp chất của crom Lời giải chi tiết :
A, B, D đúng C sai Cr không tan được trong dd NaOH loãng hay đặc
Câu 21 :
Cho các phản ứng sau: (a) NaOH + HClO → NaClO + H2O (b) Mg(OH)2 + 2HCl → MgCl2 + 2H2O (b) 3KOH + H3PO4 → K3PO4 + 3H2O (d) Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O Số phản ứng có cùng phương trình in rút gọn: H+ + OH- → H2O là
Đáp án : B Phương pháp giải :
Viết phương trình ion đầy đủ của phản ứng, sau đó giản bớt các ion chung của 2 bên ta sẽ được phương trình ion rút gọn => chọn các phương trình ion rút gọn như yêu cầu bài toán Lời giải chi tiết :
(a) OH- + HClO → ClO- + H2O (b) Mg(OH)2 + 2H+ → Mg2+ + 2H2O (c) 3OH- + H3PO4 → PO43- + 3H2O (d) OH- + H+ → H2O => chỉ có 1 phản ứng (d) có phương trình ion rút gọn là H+ + OH- → H2O
Câu 22 :
Cho hình vẽ mô tả thí nghiệm điều chế khí X khi cho dung dịch axit tác dụng với chất rắn (kim loại hoặc muối). Hình vẽ dưới minh họa phản ứng nào sau đây?
Đáp án : C Phương pháp giải :
Khí X thu được bằng cách úp ngược ống nghiệm => khí X nhẹ hơn không khí => chọn khí có phân tử khối nhẹ hơn kk (Mkk ≈ 29) Lời giải chi tiết :
Khí X thu được bằng cách úp ngược ống nghiệm => khí X nhẹ hơn không khí 1. loại NO2 nặng hơn không khí 2. loại CO2 nặng hơn không khí 3. Thỏa mãn vì H2 nhẹ hơn không khí 4. loại vì Cl2 nhẹ nặng hơn không khí
Câu 23 :
Cho 21,9 gam lysin tác dụng hoàn toàn với dung dịch NaOH dư thu được m gam muối. Giá trị của m là
Đáp án : A Phương pháp giải :
Đổi mol Lys, sau đó viết PTHH xảy ra, dựa vào PTHH ta sẽ tính được khối lượng muối Lời giải chi tiết :
nLys = 21,9 : 146 = 0,15 (mol)
nNaOH = nH2O = nLys = 0,15 (mol) BTKL: mmuối = mlys + mNaOH - mH2O = 21,9 + 0,15.40 - 18.0,15 = 25,2 (g)
Câu 24 :
Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 (loãng, dư), thu được dung dịch X. Cho dãy gồm các chất: Fe, KNO3, KMnO4, BaCl2, NaOH, Cu. Số chất trong dãy phản ứng được với dung dịch X là
Đáp án : D Phương pháp giải :
Dung dịch X thu được có chứa: Fe2+, Fe3+, SO42- ; H+. Từ đó chọn được các chất có phản ứng với dd X Lời giải chi tiết :
Fe3O4 + 4H2SO4 loãng dư → FeSO4 + Fe2(SO4)3 + 4H2O Dung dịch X thu được có chứa: Fe2+, Fe3+, SO42- ; H+ Cả 6 chất đều tác dụng được với dung dịch X là: Fe, KNO3, KMnO4, BaCl2, NaOH, Cu. Các phương trình minh họa Fe + 2H+ → Fe2+ + H2 NO3- + 4H+ + 3Fe2+ → 3Fe3+ + NO + 2H2O MnO4- + 4H+ + 3Fe2+ → 3Fe3+ + MnO2↓ + 2H2O Ba2+ + SO42- → BaSO4↓ OH- + H+ → H2O Cu + 2Fe3+ → 2Fe2+ + Cu2+
Câu 25 :
Cho m gam hỗn hợp X gồm ba este (chỉ chứa este, không có chức khác) tác dụng tối đa với 525 ml dung dịch NaOH 1M, thu được hỗn hợp Y gồm 2 ancol đơn chức cùng dãy đồng đẳng và 42,9 gam hỗn hợp muối Z. Đốt cháy hoàn toàn Y, thu được 6,72 lít khí CO2(đktc) và 9,45 gam H2O. Giá trị của m là
Đáp án : B Phương pháp giải :
Từ phản ứng đốt cháy Y, ta thấy mol CO2 < mol H2O => kết luận 2 ancol trong Y no, đơn chức, hở, cùng dãy đồng đẳng suy ra được: nY = nH2O - nCO2. Ta sẽ thấy nY < nNaOH . Do vậy kết luận được X gồm este được tạo bởi ancol và phenol. nNaOH pư với este tạo bởi phenol = ∑nNaOH - nY = ? => nH2O = 1/2 nNaOH pư với este tạo bởi phenol = ? Bảo toàn khối lượng: mX + mNaOH = mmuối + m ancol Y + mH2O. Từ đó suy ra mX = ? Lời giải chi tiết :
nNaOH = 0,525.1 = 0,525 (mol) \(X + NaOH\xrightarrow{{}}\left\langle \begin{gathered}Y:2ancol\,don\,chuc,cung\,day\,dong\,dang\xrightarrow{{ + {O_2}}}\left\{ \begin{gathered}C{O_2}:0,3 \hfill \\{H_2}O:0,525 \hfill \\ \end{gathered} \right. \hfill \\muoi\,Z:42,9\,(g) \hfill \\\end{gathered} \right.\) Đốt cháy hoàn toàn Y ta thu được nH2O > nCO2 => 2 ancol trong Y no, đơn chức. mạch hở. n 2 ancol trong Y = nH2O - nCO2 = 0,525 - 0,3 = 0,225 (mol) BTKL ta có: m ancol Y = mC + mH + mO = 0,3.12 + 0,525.2 + 0,225.16 = 8,25 (g) Ta thấy nNaOH = 0,525 > n 2 ancol trong Y = 0,225 => Trong X có este tạo bởi phenol nNaOH pư với chức este của ancol = n 2 ancol Y = 0,225 (mol) => nNaOH pư với chức este của phenol = 0,525 - 0,225 = 0,3 (mol) Vi chức este chứa phenol phản ứng với NaOH theo tỉ lệ 1: 2 và tạo ra 1 H2O => nH2O = nNaOH pư với chức este của phenol /2 = 0,3 : 2 = 0,15 (mol) Bảo toàn khối lượng ta có: mX + mNaOH = mmuối + m ancol Y + mH2O => mX + 0,525.40 = 42,9 + 8,25 + 0,15.18 => mX = 32,85 (g)
Câu 26 :
Để hòa tan hết 5,46 gam Fe cần ít nhất V (ml) dung dịch hỗn hợp H2SO4 0,3M và Fe(NO3)3 0,04M. Biết(sản phẩm khử N+5 là NO duy nhất). Giá trị của V là
Đáp án : C Phương pháp giải :
Vì cần ít nhất V (ml) dung dịch nên Fe phản ứng sẽ lên Fe2+ Viết tất cả các phản ứng của Fe với các chất có trong hỗn hợp Sau đó dùng bảo toàn e sẽ tìm ra được V =? Lời giải chi tiết :
nFe = 5,46 : 22,4 = 0,0975 (mol) nH2SO4 = 0,3V (mol) ; nFe(NO3)3 = 0,04V (mol) => nH+ = 0,6V (mol) ; nNO3- =0,12V (mol) ; nFe3+ = 0,04V (mol) Vì cần ít nhất V (ml) dung dịch nên Fe phản ứng sẽ lên Fe2+ 3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O Ta thấy: nH+ = 0,6V > 4nNO3- = 0,48V. Nên tại thời điểm NO3- hết thì H+ vẫn còn dư một lượng là nH+ dư = 0,6V - 0,48V = 0,12V (mol) => còn có phản ứng tạo H2 Fe + 2Fe3+ → 3Fe2+ Fe + 2H+ → Fe2+ + H2 Bảo toàn e ta có: 2nFe = 3nNO + nH+ dư + nFe3+ => 2.0,0975 = 3.0,12V + 0,12V + 0,04V => V = 0,375 (l) = 375 (ml)
Câu 27 :
Thực hiện các thí nghiệm sau đến phản ứng xảy ra hoàn toàn: (a) Dẫn a mol khí CO2 vào 0,8a mol Ca(OH)2 trong dung dịch. (b) Cho a mol Fe vào 3a mol HNO3 trong dung dịch (sản phẩm khử duy nhất tạo ra là NO) (c) Cho dung dịch NaHCO3 đến dư vào dung dịch Ba(OH)2. (d) Cho bột Cu vào dung dịch FeCl3 (dư) Số thí nghiệm thu được dung dịch chứa hai muối là
Đáp án : A Phương pháp giải :
Viết các phản ứng xảy ra, chọn các phản ứng thu được 2 muối trong dung dịch Lời giải chi tiết :
(a) ta thấy: \(1 < \frac{{{n_{C{O_2}}}}}{{{n_{Ca{{(OH)}_2}}}}} = \frac{a}{{0,8a}} = 1,25 < 2\) => tạo 2 muối CaCO3 và Ca(HCO3)2. Nhưng CaCO3 không tan nên dd chỉ thu được 1 muối Ca(HCO3)2 (b) nHNO3 = 4nNO => nNO = 0,75a (mol) => ne nhận = 3nNO = 2,25a (mol). Ta thấy: 2nFe < ne nhận = 2,25a < 3nFe => tạo 2 muối Fe(NO3)2 và Fe(NO3)3 (c) 2NaHCO3 dư + Ba(OH)2 → BaCO3↓ + Na2CO3 + 2H2O => dd thu được 2 muối: Na2CO3 và NaHCO3 dư (d) Cu + 2FeCl3 dư → 2FeCl2 + CuCl2 => thu được 3 muối: CuCl2, FeCl2 và FeCl3 dư => có 2 thí nghiệm (b) và (c) thu được 2 muối
Câu 28 :
Cho 26,03 gam Ba vào 100 ml dung dịch chứa Al2(SO4)3 0,5M đến khi phản ứng hoàn toàn, thu được m gam kết tủa. Phát biểu nào sau đây đúng?
Đáp án : B Phương pháp giải :
Khi cho Ba vào dd Al2(SO4)3 thì Ba sẽ phản ứng với H2O có trong dung dịch trước, tạo ra Ba(OH)2. Sau đó Ba(OH)2 sẽ phản ứng với dd Al2(SO4)3. Viết PT ion rút gọn phản ứng xảy ra sẽ thuận tiện cho tính toán. Lời giải chi tiết :
nBa = 26,03 : 137 = 0,19 (mol) ; nAl2(SO4)3 = 0,1.0,5 = 0,05 (mol) => nAl3+ = 0,1 (mol) ; nSO42- = 0,15 (mol) Ba + 2H2O → Ba(OH)2 + H2↑ 0,19 → 0,19 → 0,19 (mol) => nBa2+ = 0,19 (mol) và nOH- = 2nBa(OH)2 = 0,38 (mol) Ba2+ + SO42- → BaSO4↓ 0,15← 0,15 → 0,15 (mol) Ta thấy: \(3 < \frac{{{n_{OH}}^ - }}{{{n_{A{l^{3 + }}}}}} = \frac{{0,38}}{{0,1}} = 3,8 < 4\) => xảy ra phản ứng tạo Al(OH)3 và AlO2- Al3+ + 3OH- → Al(OH)3↓ Al3+ + 4OH- → AlO2- + 2H2O áp dụng công thức nhanh ta có: nOH- = 4nAl3+ - nAl(OH)3 => nAl(OH)3 = 4.0,1 - 0,38 = 0,02 (mol) Kết tủa gồm: BaSO4: 0,15 (mol) và Al(OH)3: 0,02 (mol) => m kết tủa = 0,15.233 + 0,02.78 = 36,51 (g) ∆ = mBa - mH2 - mkết tủa = 26,03 - 0,19.2 - 36,51 = -10,86 (g) => Khối lượng dung dịch sau phản ứng giảm 10,86 (g)
Câu 29 :
Tiến hành thí nghiệm với các chất X, Y, Z (trong dung dịch) thu được các kết quả như sau:
Đáp án : D Phương pháp giải :
X hoặc T làm quỳ tím chuyển sang màu xanh => X và T có môi trường bazo Y tạo kết tủa Ag với dd AgNO3/NH3, đun nóng => Y có nhóm -CHO trong phân tử hoặc trong môi trường bazo chuyển hóa thành chất có khả năng phản ứng tráng Ag. Z không phản ứng với AgNO3/NH3, đun nóng => Y không có nhóm -CHO Lời giải chi tiết :
X hoặc T làm quỳ tím chuyển sang màu xanh => X và T có môi trường bazo => X và T có thể là Etylamin; Lys-Gly- Ala hoặc Lys -Val- Ala. T lại tạo phức màu tím với Cu(OH)2/OH- => T là tripeptit có chứa gốc lys => X chắc chắn là etylamin Y tạo kết tủa Ag với dd AgNO3/NH3, đun nóng => Y là glucozo hoặc fructozo Z không phản ứng với AgNO3/NH3, đun nóng => Z là saccarozo Vậy X, Y, Z, T theo thứ tự phù hợp với bài toán và đáp án cho là: Etylamin, glucozo, saccarozo, Lys -Val- Ala.
Câu 30 :
Đốt cháy hoàn toàn 0,08 mol hỗn hợp X gồm (C2H2, C2H4, CH4 và C3H6), thu được 0,14 mol CO2 và 0,17 mol H2O. Mặt khác, cho 2,525 gam X phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
Đáp án : A Phương pháp giải :
Khi đốt hỗn hợp X ta có: \({n_X} = \frac{{{n_{C{O_2}}} - {n_{{H_2}O}}}}{{\overline k - 1}} \to \overline k\) *Xét 0,08 mol X: mX = mC + mH => MX *Xét phản ứng của 2,525 gam X với Br2: Tính được nX = mX : MX => nBr2 = \(\overline k \).nX = ? Lời giải chi tiết :
Khi đốt hỗn hợp X ta có: \({n_X} = \frac{{{n_{C{O_2}}} - {n_{{H_2}O}}}}{{\overline k - 1}} \to 0,08 = \frac{{0,14 - 0,17}}{{\overline k - 1}} \to \overline k = 0,625\) *Xét 0,08 mol X: mX = mC + mH = 0,14.12 + 0,17.2 = 2,02 gam => MX = 2,02 : 0,08 = 25,25 *Xét phản ứng của 2,525 gam X với Br2: nX = 2,525 : 25,25 = 0,1 mol Mà ta có: nBr2 = \(\overline k \).nX = 0,625.0,1 = 0,0625 mol
Câu 31 :
Hỗn hợp X gồm glyxin, valin, lysin và axit glutamic (trong X tỉ lệ khối lượng của nito và oxi là 7:15). Cho 7,42 gam X tác dụng vừa đủ với dung dịch HCl, thu được dung dịch Y. Dung dịch Y tác dụng vừa đủ dung dịch chứa 0,08 mol NaOH và 0,075 mol KOH, cô cạn dung dịch sau phản ứng, thu được m gam muối khan. Giá trị m là
Đáp án : B Phương pháp giải :
Đặt nN = x và nO = y (mol) => nNH2 = x mol và nCOOH = 0,5y mol mN : mO = 7:15 => (1) X tác dụng vừa đủ với HCl => nHCl = nNH2 = nN = x mol Đơn giản hóa quá trình ta coi như: {X, HCl} + {NaOH, KOH} → Muối + H2O Khi đó: nCOOH + nHCl = nNaOH + nKOH => (2) Giải hệ tìm được x, y Lời giải chi tiết :
Đặt nN = x và nO = y (mol) => nNH2 = x mol và nCOOH = 0,5y mol mN : mO = 7:15 => \(\frac{{14x}}{{16y}} = \frac{7}{{15}}\) (1) X tác dụng vừa đủ với HCl => nHCl = nNH2 = nN = x mol Đơn giản hóa quá trình ta coi như: {X, HCl} + {NaOH, KOH} → Muối + H2O Khi đó: nCOOH + nHCl = nNaOH + nKOH => 0,5y + x = 0,08 + 0,075 (2) Giải hệ (1) và (2) thu được x = 0,08 và y = 0,15 nH2O = nNaOH + nKOH = 0,155 mol BTKL: m muối = mX + mHCl + mNaOH + mKOH - mH2O = 7,42 + 0,08.36,5 + 0,08.40 + 0,075.56 - 0,155.18 = 14,95 (g)
Câu 32 :
Điện phân (với điện cực trơ, màng ngăn) dung dịch chứa hỗn hợp CuSO4 và NaCl (trong đó số mol NaCl gấp 4 lần số mol CuSO4) bằng dòng điện một chiều có cường độ ổn định. Sau t (h), thu được dung dịch X và sau 2t (h), thu được dung dịch Y. Dung dịch X tác dụng với bột Al dư, thu được 1,5a mol khí H2. Dung dịch Y tác dụng với bột Al dư, thu được 12a mol khí H2. Biết hiệu suất điện phân 100%, các phản ứng xảy ra hoàn toàn, các khí sinh ra không hòa tan vào nước. Phát biểu nào dưới đây đúng?
Đáp án : C Phương pháp giải :
Nắm được các phản ứng điện phân ở các điện cực. Lời giải chi tiết :
Đặt nCuSO4 = x mol và nNaCl = 4x mol (Giả sử a = 1) - Do khi cho Y tác dụng với Al thu được nhiều khí hơn cho X tác dụng với Al dư nên suy ra tại t (h):
- Tại 2t (h): ne(2t) = 2ne(t) = 4x + 2 (mol) > nCl- (= 4x) => tại anot Cl- đã bị điện phân hết, H2O đang điện phân Y chứa: Na+ (4x mol); SO42- (x mol) và OH- BTĐT => nOH- (dd Y) = 2x (mol) OH- → 1,5H2 2x → 3x = 12 => x = 4 => nCu2+ = 4; nCl- = 16; ne(t) = 9 - Xét A: ne(0,85t) = 0,85.9 = 7,65 < 2nCu2+ (= 8) => Cu2+ chưa điện phân hết => catot chưa có khí => A sai - Xét B: ne(2t) = 18
=> n khí = 5 + 8 + 0,5 = 13,5 mol => B sai - Xét C: ne(1,8t) = 1,8.9 = 16,2 Anot: Cl- → 0,5Cl2 + 1e 8 ← 16 H2O → 2H+ + 0,5O2 + 2e 0,05 ← 0,2 => nO2 = 0,05 mol => C đúng - Xét D: Anot: Cl- → 0,5Cl2 + 1e 4,5 ← 9 => nCl2 = 4,5 mol => D sai
Câu 33 :
Hỗn hợp E gồm ba este X, Y, Z (đều mạch hở, chỉ chứa một loại nhóm chức; trong phân tử mỗi este có số liên kết π không quá 3; MX < MY < MZ; X chiếm 50% số mol hỗn hợp). Đun nóng 11,14 gam E với dung dịch NaOH vừa đủ, thu được hỗn hợp T gồm các muối và hỗn hợp G chứa ba ancol đều no. Tỉ khối hơi của G so với H2 bằng 28,75. Đốt cháy toàn bộ T cần dùng 0,115 mol O2, thu được 9,805 gam Na2CO3 và 0,215 mol hỗn hợp gồm CO2 và H2O. Phần trăm khối lượng của Y trong E là
Đáp án : D Phương pháp giải :
Bảo toàn khối lượng, bảo toàn nguyên tố. Lời giải chi tiết :
nNa2CO3 = 9,805 : 106 = 0,0925 mol BTNT "Na" => nNaOH = 2nNa2CO3 = 0,185 mol Sơ đồ bài toán: \(11,14(g)E\left\{ \begin{gathered}X \hfill \\Y \hfill \\Z \hfill \\ \end{gathered} \right.\xrightarrow{{ + NaOH:0,185}}\left\{ \begin{gathered}Muoi\,T\xrightarrow{{ + {O_2}:0,115}}\left\{ \begin{gathered}N{a_2}C{O_3}:0,0925 \hfill \\ \left. \begin{gathered}C{O_2}:x \hfill \\{H_2}O:y \hfill \\ \end{gathered} \right\}0,{215^{mol}} \hfill \\ \end{gathered} \right. \hfill \\Ancol\,G({\overline M _G} = 57,5)\hfill \\ \end{gathered} \right.\) nO(T) = 2nCOO = 2.nNaOH = 0,37 mol *Xét phản ứng đốt T: + nCO2 + nH2O = x + y = 0,215 (1) + BTNT "O": nO(T) + 2nO2 = 3nNa2CO3 + 2nCO2 + nH2O => 0,37 + 0,115.2 = 0,0925.3 + 2x + y (2) Giải hệ (1) và (2) được: x = y = 0,1075 Khi đốt muối thu được nCO2 = nH2O => Muối của axit đơn chức, no, mạch hở => nT = nNaOH = 0,185 mol nC(T) = nCO2 + nNa2CO3 = 0,1075 + 0,0925 = 0,2 mol => C trung bình = nC(T) : nT = 0,2 : 0,185 = 1,081 => T có chứa HCOONa BTKL: mT = mNa2CO3 + mCO2 + mH2O - mO2 = 9,805 + 0,1075.44 + 0,1075.18 - 0,115.32 = 12,79 gam *Xét phản ứng thủy phân E trong NaOH: mG = 11,14 + 0,185.40 - 12,79 = 5,75 gam => nG = 5,75 : 57,5 = 0,1 mol nOH = nNaOH = 0,185 mol => Số nhóm OH trung bình = 0,185 : 0,1 = 1,85 Gọi công thức chung của ancol là CnH2n+2O1,85 MG = 57,5 => 14n + 2 + 1,85.16 = 57,5 => n = 1,85 => Có CH3OH Ta thấy số C trung bình bằng với số nhóm OH trung bình, mà số liên kết pi của X, Y, Z không vượt quá 3 nên suy ra 3 ancol là: CH3OH (a mol), C2H4(OH)2 (b mol) và C3H5(OH)3 (c mol) X có phân tử khối nhỏ nhất => X là HCOOCH3 + nG = a + b + c = 0,1 + nOH(G) = a + 2b + 3c = 0,185 + nX = 50%.nG => a = 0,5(a + b + c) Giải hệ thu được a = 0,05; b = 0,015; c = 0,035 Quy đổi muối gồm: HCOONa (0,185 mol) và CH2 => mCH2 = 12,79 - 0,185.68 = 0,21 (g) => nCH2 = 0,21 : 14 = 0,015 mol \(T\left\{ \begin{gathered}HCOONa:0,185 \hfill \\C{H_2}:0,015 \hfill \\ \end{gathered} \right.\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,G\left\{ \begin{gathered}C{H_3}OH:0,05 \hfill \\{C_2}{H_4}{(OH)_2}:0,015 \hfill \\{C_3}{H_5}{(OH)_3}:0,035 \hfill \\ \end{gathered} \right.\) Ghép số mol lại suy ra X, Y, Z là: X: HCOOCH3 (0,05 mol) Y: (HCOO)2(CH2)C2H4 (0,015 mol) Z: (HCOO)3C3H5 (0,035 mol) => %mY = 17,774% gần nhất với 17,77%
Câu 34 :
Hỗn hợp E gồm X (C7H16O6N2) và Y (C5H14O4N2, là muối của axit cacboxylic hai chức) tác dụng hoàn toàn với dung dịch KOH, thu được ancol etylic, hai amin no (đơn chức, kế tiếp trong dãy đồng đẳng, có tỉ khối hơi so với khí hidro bằng 16,9) và dung dịch Z. Cô cạn dung dịch Z, thu được hỗn hợp T gồm 2 muối khan có cùng số nguyên tử cacbon trong phân tử (trong đó có 1 muối của axit cacboxylic và 1 muối của α-amino axit). Phần trăm khối lượng của muối có phân tử khối nhỏ hơn trong T là
Đáp án : D Phương pháp giải :
Dựa vào tỉ khối suy ra 2 amin là CH3NH2 và C2H5NH2 => Y là CH3NH3OOC-COONH3COOC2H5 Dùng phương pháp đường chéo tính được tỉ lệ số mol 2 amin. nCH3NH2 > nC2H5NH2 => X tác dụng với KOH cũng sinh ra CH3NH2 T gồm 2 muối khan có cùng số nguyên tử cacbon trong phân tử (trong đó có 1 muối của axit cacboxylic và 1 muối của α-amino axit) => Các muối đều có chứa 2C => Muối gồm: (COOK)2 và H2N-CH2-COOK Suy ra cấu tạo thỏa mãn của X. Lời giải chi tiết :
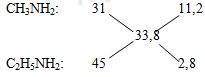
M amin = 16,9.2 = 33,8 => 2 amin là CH3NH2 (a mol) và C2H5NH2 (b mol) => Y là CH3NH3OOC-COONH3COOC2H5
=> a : b = 11,2 : 2,8 = 4 : 1 nCH3NH2 > nC2H5NH2 => X tác dụng với KOH cũng sinh ra CH3NH2 T gồm 2 muối khan có cùng số nguyên tử cacbon trong phân tử (trong đó có 1 muối của axit cacboxylic và 1 muối của α-amino axit) => Các muối đều có chứa 2C => Muối gồm: (COOK)2 và H2N-CH2-COOK Suy ra X có cấu tạo là: C2H5OOC-COONH3-CH2COONH3CH3 hoặc CH3NH3OOC-COONH3-CH2-COOC2H5 Giả sử: nCH3NH2 = 4 mol => nC2H5NH2 = 1 mol nY = nC2H5NH2 = 1 mol nX = nCH3NH2 - nY = 4 - 1 = 3 mol Vậy muối gồm: (COOK)2 (3 + 1 = 4 mol) và H2N-CH2-COOK (3 mol) => %mGly-K = 3.113/(4.166 + 3.113).100% = 33,79% gần nhất với giá trị 33,8%
Câu 35 :
Cho các phát biểu sau: (a) Thép là hợp kim của sắt với cacbon và một số nguyên tố khác, trong đó có từ 0,01-2% khối lượng cacbon. (b) Bột nhôm trộn với bột Fe2O3 dùng để hàn đường ray bằng phản ứng nhiệt nhôm. (c) Phèn chua và thạch cao sống có công thức hóa học lần lượt là KAl(SO4)2.12H2O và CaSO4.2H2O. (d) Thạch cao nung dùng để nặn tượng, bó bột khi gãy xương. (e) Dung dịch Na2CO3, Na3PO4 làm mềm được nước cứng. (g) Miếng gang để trong không khí ẩm xảy ra ăn mòn điện hóa. Số phát biểu đúng là
Đáp án : D Lời giải chi tiết :
(a) đúng (b) đúng, hỗn hợp đó được gọi là hỗn hợp tecmit dùng để hàn đường ray (c) đúng (d) đúng, thạch cao nung CaSO4.H2O hoặc CaSO4.0,5H2O được dùng để nặn tượng hoặc bó bột khi gãy xương (e) đúng (g) đúng, vì khi đó cặp điện cực Fe-C được tiếp xúc với môi trường điện li là không khí ẩm nên xảy ra ăn mòn điện hóa. Vậy có tất cả 6 phát biểu đúng
Câu 36 :
Peptit X mạch hở được cấu tạo từ hai loại α-amino axit A, B (đều no, mạch hở, đều chứa một nhóm -NH2). Biết X tác dụng hoàn toàn với dung dịch NaOH theo phản ứng sau: X + 11NaOH → 3A + 4B + 5H2O Đốt cháy hoàn toàn a mol X thu được hỗn hợp gồm N2, H2O và 29a mol CO2. Hỗn hợp các peptit mạch hở E gồm tripeptit A2B, tetrapeptit A2B2, pentapeptit A2B3 và đipeptit A-A. Đốt cháy hết b gam E trong oxi thu được N2, 0,5625 mol H2O và 0,675 mol CO2. Mặt khác, cho 0,15 mol E tác dụng hết với dung dịch NaOH dư, đun nóng sau khi phản ứng xảy ra hoàn toàn, cô cạn dung dịch, thu được chất rắn khan chứa c gam muối. Giá trị của c gần nhất với
Đáp án : A Phương pháp giải :
X + 11NaOH → 3A + 4B + 5H2O Dựa vào PTHH ta thấy X là heptapeptit. Mặt khác: 3 + 4.2 = 11 => A có chứa 1 nhóm COOH còn B chứa 2 nhóm COOH Đốt cháy hoàn toàn a mol X thu được 29a mol CO2 => Số C trong X là 29 X có dạng A3B4 Giả sử số C của A và B lần lượt là n, m. => 3n + 4m = 29 có cặp nghiệm thỏa mãn là n = 3, m = 5 Vậy A là Ala, B là Glu *Xét phản ứng đốt b gam E trong O2: Nhận thấy các peptit đều có 2 mắt xích Ala nên ta đặt công thức trung bình là Ala2Glun Dựa vào tỉ lệ số mol CO2 và H2O tính được n. Lời giải chi tiết :
X + 11NaOH → 3A + 4B + 5H2O Dựa vào PTHH ta thấy X là heptapeptit. Mặt khác: 3 + 4.2 = 11 => A có chứa 1 nhóm COOH còn B chứa 2 nhóm COOH Đốt cháy hoàn toàn a mol X thu được 29a mol CO2 => Số C trong X là 29 X có dạng A3B4 Giả sử số C của A và B lần lượt là n, m. => 3n + 4m = 29 có cặp nghiệm thỏa mãn là n = 3, m = 5 Vậy A là Ala, B là Glu *Xét phản ứng đốt b gam E trong O2: Nhận thấy các peptit đều có 2 mắt xích Ala nên ta đặt công thức trung bình là Ala2Glun hay; (C3H7O2N)2(C5H9O4N)n - (n+1)H2O hay C5n+6H7n+12O3n+3Nn+2 \(\frac{C}{H} = \frac{{{n_{C{O_2}}}}}{{2{n_{{H_2}O}}}} \to \frac{{5n + 6}}{{7n + 12}} = \frac{{0,675}}{{0,5625.2}} \to n = 1,5\) => Công thức trung bình là Ala2Glu1,5 *Xét phản ứng thủy phân 0,15 mol E trong NaOH dư: nAla-Na = 0,15.2 = 0,3 mol nGlu-Na2 = 0,15.1,5 = 0,225 mol => m muối = 0,3.(89 + 22) + 0,225.(147 + 22.2) = 76,275 gam gần nhất với giá trị 76 gam
Câu 37 :
Hòa tan hết m gam hỗn hợp gồm Na, Na2O, Ba, BaO vào nước, thu được 0,06 mol khí H2 và dung dịch X. Hấp thụ hết 0,128 mol khí CO2 vào dung dịch X, thu được dung dịch Y (chỉ chứa các muối) và kết tủa Z. Chia dung dịch Y làm 2 phần bằng nhau: + Cho từ từ phần 1 vào 200 ml dung dịch HCl 0,24M thấy thoát ra 0,03 mol khí CO2. + Nếu cho từ từ 200 ml dung dịch HCl 0,24M vào phần 2 thấy thoát ra 0,024 mol khí CO2. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
Đáp án : C Phương pháp giải :
Do lượng CO2 thu được ở 2 thí nghiệm khác nhau mặc dù lượng HCl như nhau nên X chứa CO32-, HCO3- và Na+ + Phần 1: Cho từ từ CO32-, HCO3- vào H+ thì phản ứng xảy ra đồng thời theo đúng tỉ lệ về số mol (vì ban đầu H+ rất dư) CO32- + 2H+ → H2O + CO2 HCO3- + H+ → H2O + CO2 Dựa vào số mol H+ phản ứng và số mol CO2 sinh ra => nCO32- : nHCO3- = 3 : 2 + Phần 2: Đặt nCO32- = 3a (mol) và nHCO3- = 2a (mol) Cho từ từ H+ vào hỗn hợp CO32- và HCO3- thì phản ứng xảy ra theo thứ tự: CO32- + H+ → HCO3- 3a → 3a → 3a HCO3- + H+ → CO2 + H2O 0,024 ← 0,024 Từ số mol H+ đề bài cho tính được a. => Thành phần dung dịch Y BTNT "C": nCO2 = nCO32-(Y) + nHCO3- (Y) + nBaCO3 => nBaCO3 = nBa (hh) nNa(hh) = nNa+ BT electron: nNa + 2nBa = 2nO + 2nH2 => nO => m = mNa + mBa + mO Lời giải chi tiết :
Do lượng CO2 thu được ở 2 thí nghiệm khác nhau mặc dù lượng HCl như nhau nên X chứa CO32-, HCO3- và Na+ + Phần 1: Cho từ từ CO32-, HCO3- vào H+ thì phản ứng xảy ra đồng thời theo đúng tỉ lệ về số mol (vì ban đầu H+ rất dư) CO32- + 2H+ → H2O + CO2 x ← 2x → x HCO3- + H+ → H2O + CO2 y ← y → y => nCO2 = x + y = 0,03 mol; nH+ = 2x + y = 0,24.0,2 Giải hệ thu được x = 0,018 và y = 0,012 => nCO32- : nHCO3- = 0,018 : 0,012 = 3 : 2 + Phần 2: Đặt nCO32- = 3a (mol) và nHCO3- = 2a (mol) Cho từ từ H+ vào hỗn hợp CO32- và HCO3- thì phản ứng xảy ra theo thứ tự: CO32- + H+ → HCO3- 3a → 3a → 3a HCO3- + H+ → CO2 + H2O 0,024 ← 0,024 => nH+ = 3a + 0,024 = 0,048 => a = 0,008 Vậy 1/2 dung dịch Y gồm: CO32- (0,024 mol), HCO3- (0,016 mol) => dd Y gồm: CO32- (0,048 mol), HCO3- (0,032 mol) và Na+ (0,128 mol) (theo BTĐT) BTNT "C": nCO2 = nCO32-(Y) + nHCO3- (Y) + nBaCO3 => 0,128 = 0,048 + 0,032 + nBaCO3 => nBaCO3 = 0,048 mol => nBa (hh) = nBaCO3 = 0,048 mol nNa(hh) = nNa+ = 0,128 mol BT electron: nNa + 2nBa = 2nO + 2nH2 => 0,128 + 2.0,048 = 2nO + 2.0,06 => nO = 0,052 => m = mNa + mBa + mO = 0,128.23 + 0,048.137 + 0,052.16 = 10,352 gam
Câu 38 :
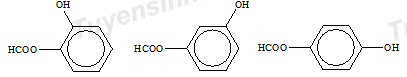
Cho 1 mol chất X (C7HyO3, chứa vòng benzen) tác dụng hết với NaOH dư, thu được 1 mol chất Y, 1 mol chất Z và 2 mol H2O (trong đó MY < MZ; có 3 mol NaOH tham gia phản ứng). Chất Z tác dụng với dung dịch H2SO4 loãng dư thu được T (Y, Z, T là các hợp chất hữu cơ). Phát biểu nào sau đây sai?
Đáp án : B Phương pháp giải :
Cho 1 mol chất X (C7HyO3, chứa vòng benzen) tác dụng hết với NaOH dư, thu được 1 mol chất Y, 1 mol chất Z và 2 mol H2O (trong đó MY < MZ; có 3 mol NaOH tham gia phản ứng) => X có chứa 2 chức COO gắn trực tiếp với vòng benzen và 1 chức phenol. Lời giải chi tiết :
Cho 1 mol chất X (C7HyO3, chứa vòng benzen) tác dụng hết với NaOH dư, thu được 1 mol chất Y, 1 mol chất Z và 2 mol H2O (trong đó MY < MZ; có 3 mol NaOH tham gia phản ứng) => X có chứa 2 chức COO gắn trực tiếp với vòng benzen và 1 chức phenol. CTCT thỏa mãn của X:
=> Y là HCOONa Z là C6H4(ONa)2 => T là C6H4(OH)2 A đúng vì HCOONa có chứa cấu trúc -CH=O nên vừa làm mất màu Br2 và có phản ứng tráng bạc B sai vì HCOONa không phản ứng được với NaOH (xt CaO) C đúng vì X và T đều có chứa 6 nguyên tử H D đúng
Câu 39 :
Cho 11,2 gam hỗn hợp X gồm Fe, FeO, Fe2O3, CuO vào dung dịch HCl, thu được chất rắn Y (chỉ chứa một kim loại), dung dịch Z (chỉ chứa muối) và 448 ml H2 (đktc). Cho lượng Y này phản ứng với dung dịch HNO3 (dư) đậm đặc, nung nóng, thu được 896 ml khí NO2 (đktc, sản phẩm khử duy nhất của N+5). Cho dung dịch Z trên vào dung dịch AgNO3 dư, thu được 53,14 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Khối lượng của CuO trong X là
Đáp án : C Phương pháp giải :
Kim loại Y là Cu => tạo muối Fe2+ *Cho Y tác dụng với HNO3 đặc nóng: BTe: 2nCu = nNO2 => nCu *Quy đổi hỗn hợp X thành: Fe (x mol); Cu (y mol) và O (z mol) Bảo toàn nguyên tố, bảo toàn điện tích suy ra sơ đồ bài toán: \(11,2(g)X\left\{ \begin{gathered}Fe:x \hfill \\Cu:y \hfill \\O:z \hfill \\ \end{gathered} \right.\xrightarrow{{ + HCl}}\left| \begin{gathered}Y\left\{ {Cu:0,02} \right\}\xrightarrow{{ + HN{O_3}dac,{t^o}}}N{O_2}:0,04 \hfill \\Z\left\{ \begin{gathered}F{e^{2 + }}:x \hfill \\C{u^{2 + }}:y - 0,02 \hfill \\\xrightarrow{{BTDT}}C{l^ - }:2x + 2y - 0,04 \hfill \\ \end{gathered} \right\}\xrightarrow{{AgN{O_3}du}}53,14(g)\left\{ \begin{gathered}AgCl:2x + 2y - 0,04 \hfill \\Ag:x \hfill \\ \end{gathered} \right. \hfill \\{H_2}:0,02 \hfill \\ \end{gathered} \right.\) Lập hệ phương trình dựa vào khối lượng X, bảo toàn e và khối lượng kết tủa suy ra x, y, z Lời giải chi tiết :
Kim loại Y là Cu => tạo muối Fe2+ *Cho Y tác dụng với HNO3 đặc nóng: BTe: 2nCu = nNO2 => 2nCu = 0,04 => nCu = 0,02 *Quy đổi hỗn hợp X thành: Fe (x mol); Cu (y mol) và O (z mol) Sơ đồ bài toán: \(11,2(g)X\left\{ \begin{gathered}Fe:x \hfill \\Cu:y \hfill \\O:z \hfill \\ \end{gathered} \right.\xrightarrow{{ + HCl}}\left| \begin{gathered}Y\left\{ {Cu:0,02} \right\}\xrightarrow{{ + HN{O_3}dac,{t^o}}}N{O_2}:0,04 \hfill \\ Z\left\{ \begin{gathered}F{e^{2 + }}:x \hfill \\C{u^{2 + }}:y - 0,02 \hfill \\\xrightarrow{{BTDT}}C{l^ - }:2x + 2y - 0,04 \hfill \\ \end{gathered} \right\}\xrightarrow{{AgN{O_3}du}}53,14(g)\left\{ \begin{gathered}AgCl:2x + 2y - 0,04 \hfill \\Ag:x \hfill \\ \end{gathered} \right. \hfill \\{H_2}:0,02 \hfill \\ \end{gathered} \right.\) + mX = 56x + 64y + 16z = 11,2 (1) + BT electron cho quá trình X phản ứng HCl: 2nFe + 2nCu pư = 2nO + 2nH2 => 2x + 2(y - 0,02) = 2z + 0,02.2 (2) + m kết tủa = mAgCl + mAg => 143,5(2x + 2y - 0,04) + 108x = 53,14 (3) Giải hệ (1) (2) (3) được x = 0,12; y = 0,04; z = 0,12 => nCuO = nCu = 0,04 mol => mCuO = 0,04.80 = 3,2 gam |