Đề thi giữa kì 1 Hóa 8 - Đề số 3Đề bài
Câu 1 :
Số proton trong hạt nhân của nguyên tử Fe là:
Câu 2 :
Đốt photpho trong oxi thu được chất điphotpho pentaoxit. Phương trình chữ nào sau đây biểu diễn đúng phản ứng hóa học trên.
Câu 3 :
Phương trình hóa học nào sau đây là đúng?
Câu 4 :
Trong phản ứng: Magie + axit sunfuric → magie sunfat + khí hiđro. Magie sunfat là
Câu 5 :
Hỗn hợp là sự trộn lẫn của mấy chất với nhau?
Câu 6 :
Cho dãy các cụm từ sau, dãy nào dưới đây chỉ chất?
Câu 7 :
Chọn một phương pháp thích hợp để tách muối ăn từ nước biển.
Câu 8 :
Số……..là số đặc trưng của một nguyên tố hóa học
Câu 9 :
Chọn một phương pháp thích hợp để tách muối ăn từ nước biển.
Câu 10 :
Cho các hiện tượng sau: (1) Đinh sắt để lâu trong không khí bị gỉ (2) Mực hòa tan vào nước (3) Khi đánh diêm có lửa bắt cháy (4) Cho vôi sống ( CaO) hòa tan vào nước, thu được dung dịch vôi tôi. (5) Mặt trời mọc sương bắt đầu tan (6) Sắt nung nóng để thành rèn dao, cuốc, xẻng (7) Giũa một đinh sắt thành mạt sắt (8) Cồn để trong lọ không đậy nắp kín để lâu ngày bay hơi hết. Số các hiện tượng vật lí là:
Câu 11 :
Khí oxi do nguyên tố oxi tạo nên; nước do 2 nguyên tố: oxi và hidro tạo nên; tinh bột do 3 nguyên tố: cacbon, hidro và oxi tạo nên. Nguyên tố nào cho dưới đây là nguyên liệu cấu tạo chung của các chất này?
Câu 12 :
CTHH của hợp chất gồm 2nguyên tử Phot pho và 5 nguyên tử Oxi là
Câu 13 :
Đốt 3,2 gam S trong không khí thu được 6,4 gam khí SO2. Lượng khí oxi tham gia phản ứng bao nhiêu?
Câu 14 :
Ý nghĩa của công thức hóa học là ?
Câu 15 :
Trong các cách phát biểu về định luật bảo toàn khối lượng như sau, cách phát biểu nào đúng:
Câu 16 :
Vì sao khối lượng nguyên tử được coi bằng khối lượng hạt nhân?
Câu 17 :
Cho phương trình hóa học: aP2O5 + bH2O → cH3PO4. Sau khi cân bằng phương trình phản ứng thì giá trị của b là
Câu 18 :
Câu nào sau đây sai?
Câu 19 :
Tổng số hạt trong nguyên tử là 36, trong đó số hạt không mang điện chiếm xấp xỉ 50%. Số proton có trong nguyên tử là:
Câu 20 :
Cho nguyên tử khối của Bari là 137 đvC. Khối lượng thực nguyên tố trên là
Câu 21 :
Phân tử khối của hợp chất Fe(OH)3 bằng
Câu 22 :
Cho kim loại M tạo ra hợp chất MSO4. Biết phân tử khối của MSO4 là 152. Xác định kim loại M
Câu 23 :
Công thức hoá học phù hợp của Si(IV) là:
Câu 24 :
Công thức hóa học của nguyên tố nhôm Al (III) và gốc sunfat SO4 (II) là
Câu 25 :
Phân tử A có phân tử khối là 64 (đvC) và được tạo bởi từ 2 nguyên tố S và O. Xác định công thức hóa học của A.
Câu 26 :
Thành phần phần trăm của Cu trong hợp chất CuO là:
Câu 27 :
Khi cho đường kính vào nước khuấy lên thấy đường tan thành dạng lỏng (giai đoạn 1). Đun đường lỏng trên chảo một lúc sau có chất màu nâu đỏ chuyển dần thành đen và có mùi khét (giai đoạn 2). Hãy cho biết giai đoạn nào là hiện tượng hóa học?
Câu 28 :
Đốt cháy m gam chất Y cần dùng 6,4 g oxi thu được 4,4 gam khí CO2 và 3,6 g H2O. Khối lượng m có giá trị nào sau đây:
Câu 29 :
Cho phản ứng: 2H2 + O2 \(\xrightarrow{{{t^0}}}\) 2H2O Nếu khối lượng của O2 là 3,2g; của H2O là 3,6g thì khối lượng của hiđro là bao nhiêu gam?
Câu 30 :
Cho phương trình hóa học: AgNO3 \(\xrightarrow{{{t^0}}}\) Ag + NO2 + O2 Sử dụng phương pháp cân bằng kim loại – phi kim cân bằng phương trình trên và cho biết tỉ lệ hệ số các chất trong phương trình lần lượt là:
Câu 31 :
Cân bằng phương trình hóa học sau: C2H7N + O2 \(\xrightarrow{{{t^0}}}\) CO2 + H2O + N2 và cho biết hệ số của phân tử O2 sau khi cân bằng
Câu 32 :
Biết rằng nhôm Al tác dụng với khí oxi tạo ra chất Al2O3. Lập phương trình hóa học của phản ứng và cho biết tỉ lệ số nguyên tử Al lần lượt với số phân tử của hai chất khác trong phản ứng.
Câu 33 :
Cân bằng phương trình hóa học sau: C3H4O + O2 \(\xrightarrow{{{t^0}}}\) CO2 + H2O và cho biết hệ số của nguyên tố O2 sau khi phương trình cân bằng
Câu 34 :
Biết rằng khí etilen C2H4 cháy là phản ứng xảy ra với oxi O2, sinh ra CO2 và nước. Lập phương trình hóa học của phản ứng và cho biết phát biểu nào sau đây sai
Câu 35 :
Hợp chất A tạo bởi H và nhóm nguyên tử (XOy) hóa trị III. Biết rằng phân tử khối của A nặng bằng phân tử khối H2SO4 và nguyên tố oxi chiếm 65,31% về khối lượng của A. Công thức hóa học của hợp chất A là
Lời giải và đáp án
Câu 1 :
Số proton trong hạt nhân của nguyên tử Fe là:
Đáp án : B Lời giải chi tiết :
Từ hình vẽ cho thấy Fe có tổng 26 e → hạt nhân của Fe có 26 hạt proton
Câu 2 :
Đốt photpho trong oxi thu được chất điphotpho pentaoxit. Phương trình chữ nào sau đây biểu diễn đúng phản ứng hóa học trên.
Đáp án : C Lời giải chi tiết :
Đốt photpho trong oxi thu được chất điphotpho pentaoxit hay photpho tác dụng với oxi thu được chất điphotpho pentaoxit Photpho + khí oxi $\xrightarrow{{{t^o}}}$ điphotpho pentaoxit
Câu 3 :
Phương trình hóa học nào sau đây là đúng?
Đáp án : C Lời giải chi tiết :
Đáp án C
Câu 4 :
Trong phản ứng: Magie + axit sunfuric → magie sunfat + khí hiđro. Magie sunfat là
Đáp án : B Lời giải chi tiết :
Magie + axit sunfuric → magie sunfat + khí hiđro (chất tham gia) (sản phẩm) => magie sunfat là chất sản phẩm
Câu 5 :
Hỗn hợp là sự trộn lẫn của mấy chất với nhau?
Đáp án : A Lời giải chi tiết :
Hỗn hợp là 2 hay nhiều chất trộn lại với nhau. Mỗi chất trong hỗn hợp được gọi là 1 chất thành phần
Câu 6 :
Cho dãy các cụm từ sau, dãy nào dưới đây chỉ chất?
Đáp án : B Lời giải chi tiết :
Dãy các chất là: Muối ăn, đường kính, bột sắt, nước cất Loại A vì bàn ghế là vật thể Loại C vì bút chì, thước kẻ là vật thể Loại D vì chảo gang là vật thể
Câu 7 :
Chọn một phương pháp thích hợp để tách muối ăn từ nước biển.
Đáp án : B Phương pháp giải :
Dựa vào tính tan và khả năng bay hơi của muối Lời giải chi tiết :
Nước biển rất giàu hàm lượng muối ăn (NaCl), làm bay hơi hết nước ta sẽ thu được muối ăn ở dạng rắn khan
Câu 8 :
Số……..là số đặc trưng của một nguyên tố hóa học
Đáp án : A Lời giải chi tiết :
Số Proton là số đặc trưng của một nguyên tố hóa học
Câu 9 :
Chọn một phương pháp thích hợp để tách muối ăn từ nước biển.
Đáp án : B Phương pháp giải :
Dựa vào tính tan và khả năng bay hơi của muối Lời giải chi tiết :
Nước biển rất giàu hàm lượng muối ăn (NaCl), làm bay hơi hết nước ta sẽ thu được muối ăn ở dạng rắn khan
Câu 10 :
Cho các hiện tượng sau: (1) Đinh sắt để lâu trong không khí bị gỉ (2) Mực hòa tan vào nước (3) Khi đánh diêm có lửa bắt cháy (4) Cho vôi sống ( CaO) hòa tan vào nước, thu được dung dịch vôi tôi. (5) Mặt trời mọc sương bắt đầu tan (6) Sắt nung nóng để thành rèn dao, cuốc, xẻng (7) Giũa một đinh sắt thành mạt sắt (8) Cồn để trong lọ không đậy nắp kín để lâu ngày bay hơi hết. Số các hiện tượng vật lí là:
Đáp án : C Lời giải chi tiết :
Các hiện tượng vật lí là: (2) (5) (6) (7) (8)
Câu 11 :
Khí oxi do nguyên tố oxi tạo nên; nước do 2 nguyên tố: oxi và hidro tạo nên; tinh bột do 3 nguyên tố: cacbon, hidro và oxi tạo nên. Nguyên tố nào cho dưới đây là nguyên liệu cấu tạo chung của các chất này?
Đáp án : D Lời giải chi tiết :
Cả 3 chất đều được cấu tạo chung từ nguyên tố oxi
Câu 12 :
CTHH của hợp chất gồm 2nguyên tử Phot pho và 5 nguyên tử Oxi là
Đáp án : D Lời giải chi tiết :
P2O5
Câu 13 :
Đốt 3,2 gam S trong không khí thu được 6,4 gam khí SO2. Lượng khí oxi tham gia phản ứng bao nhiêu?
Đáp án : D Phương pháp giải :
Áp dụng định luật bảo toàn khối lượng ta có: ms + mO2 = mSO2 => mO2 = mSO2 – mS = ? Lời giải chi tiết :
S + O2 \(\xrightarrow{{{t^0}}}\) SO2↑ Áp dụng định luật bảo toàn khối lượng ta có: mS + mO2 = mSO2 => mO2 = mSO2 – mS = 6,4 – 3,2 = 3,2 (g)
Câu 14 :
Ý nghĩa của công thức hóa học là ?
Đáp án : D Lời giải chi tiết :
Ý nghĩa của công thức hóa học - Nguyên tố nào tạo ra chất - Số nguyên tử của mỗi nguyên tố trong 1 phân tử chất - Phân tử khối của chất
Câu 15 :
Trong các cách phát biểu về định luật bảo toàn khối lượng như sau, cách phát biểu nào đúng:
Đáp án : C Lời giải chi tiết :
Trong một phản ứng hoá học, tổng khối lượng của các sản phẩm bằng tổng khối lượng của các chất phản ứng.
Câu 16 :
Vì sao khối lượng nguyên tử được coi bằng khối lượng hạt nhân?
Đáp án : A Lời giải chi tiết :
Khối lượng của hạt: \({{m}_{p}}={{m}_{n}}=1,{{6726.10}^{-27}}kg\) , \({{m}_{e}}=9,{{1094.10}^{-31}}kg\) Như vậy, khối lượng của electron nhỏ hơn nhiều khối lượng proton và notron. Nên khi tính khối lượng tương đối của nguyên tử có thể bỏ qua khối lượng của electron.
Câu 17 :
Cho phương trình hóa học: aP2O5 + bH2O → cH3PO4. Sau khi cân bằng phương trình phản ứng thì giá trị của b là
Đáp án : C Lời giải chi tiết :
aP2O5 + bH2O → cH3PO4 Ở bên phải có 3 nguyên tử H, bên trái có 2 nguyên tử H => thêm 2 vào trước H3PO4 để làm chẵn số H aP2O5 + bH2O → 2H3PO4 ở bên phải có 6 nguyên tử H và 2 nguyên tử P => bên trái cần thêm 3 vào H2O và không cần thêm hệ số trước P2O5 => phương trình hóa học: P2O5 + 3H2O → 2H3PO4
Câu 18 :
Câu nào sau đây sai?
Đáp án : C Lời giải chi tiết :
Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện
Câu 19 :
Tổng số hạt trong nguyên tử là 36, trong đó số hạt không mang điện chiếm xấp xỉ 50%. Số proton có trong nguyên tử là:
Đáp án : A Phương pháp giải :
Hạt không mang điện là notron, chiếm 50% → n = ? Dựa vào dữ kiện tổng số hạt là 36 tìm được nốt p = e = (36-n)/2 =? Lời giải chi tiết :
Hạt không mang điện là notron, chiếm 50% \( \Rightarrow n = 36 \times \frac{{50\% }}{{100\% }} = 18\)(hạt) Tổng số hạt proton và electron còn lại là: 36 – 18 = 18 (hạt) Nguyên tử trung hòa về điện nên số proton = số electron = 18/2 = 9 (hạt)
Câu 20 :
Cho nguyên tử khối của Bari là 137 đvC. Khối lượng thực nguyên tố trên là
Đáp án : D Phương pháp giải :
1 đvC =$\dfrac{1}{{12}}$ khối lượng nguyên tử C = $\dfrac{1}{{12}}.1,{9926.10^{ - 23}}\,\,gam$ Lời giải chi tiết :
Nguyên tử khối của Bari là 137 đvC Mà 1 đvC = $\dfrac{1}{{12}}$ khối lượng nguyên tử C = $\dfrac{1}{{12}}.1,{9926.10^{ - 23}}\,\,gam$ => 137 đvC = $137.\dfrac{1}{{12}}.1,{9926.10^{ - 23}}\,\,gam$ = 2,275.10-22 gam
Câu 21 :
Phân tử khối của hợp chất Fe(OH)3 bằng
Đáp án : A Phương pháp giải :
Ghi nhớ phân tử khối của nguyên tố Fe, H, O ở bảng 1- sgk hóa trang 42 Lời giải chi tiết :
Phân tử khối của Fe(OH)3 bằng 56 + (16+1).3 = 107 đvC ( hoặc g/mol)
Câu 22 :
Cho kim loại M tạo ra hợp chất MSO4. Biết phân tử khối của MSO4 là 152. Xác định kim loại M
Đáp án : C Phương pháp giải :
+) Gọi nguyên tử khối của kim loại M là m +) Lập phương trình tính phân tử khối của MSO4 theo m, giải phương trình tìm m +) Dựa vào bảng nguyên tố => kim loại M Lời giải chi tiết :
Gọi nguyên tử khối của kim loại M là m => Phân tử khối của MSO4 = m + 32 + 16.4 = 152 => m = 56 Dựa vào bảng nguyên tố => kim loại M là Fe
Câu 23 :
Công thức hoá học phù hợp của Si(IV) là:
Đáp án : B Phương pháp giải :
Áp dụng biểu thức tính hóa trị: \[\mathop {{A_x}}\limits^a \mathop {{B_y}}\limits^b \Rightarrow a.x = b.y\] Lời giải chi tiết :
Gọi công thức Si với O là SixOy Ta có: \[\mathop {S{i_x}}\limits^{IV} \mathop {{O_y}}\limits^{II} \Rightarrow x.IV = y.II \Rightarrow \dfrac{x}{y} = \dfrac{{II}}{{IV}} = \dfrac{1}{2}\] => SiO2
Câu 24 :
Công thức hóa học của nguyên tố nhôm Al (III) và gốc sunfat SO4 (II) là
Đáp án : B Phương pháp giải :
Theo quy tắc hóa trị Lời giải chi tiết :
Gọi công thức hóa học của hợp chất là: Alx(SO4)y Theo quy tắc hóa trị ta có: \(\begin{gathered} Chọn x = 2 ; y = 3 Vậy công thức của hợp chất là: Al2(SO4)3
Câu 25 :
Phân tử A có phân tử khối là 64 (đvC) và được tạo bởi từ 2 nguyên tố S và O. Xác định công thức hóa học của A.
Đáp án : B Phương pháp giải :
Bước 1: Gọi công thức tổng quát dạng SxOy Bước 2: Dựa vào phân tử khối của SxOy => lập phương trình 2 ẩn x và y Bước 3: Cho x tăng dần các giá trị từ 1, 2, 3… và tìm các giá trị y tương ứng. Dựa vào điều kiện x và y đều là các số nguyên dương để chọn giá trị phù hợp. Bước 4: Kết luận CTHH phù hợp. Lời giải chi tiết :
Gọi công thức hóa học của A là: ${S_x}{O_y}$ $\begin{gathered}{M_A} = x.{M_S} + y.{M_O} \hfill \\\Leftrightarrow 64 = 32x + 16y \hfill \\ \end{gathered} $ 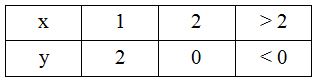 $ \Rightarrow x = 1;y = 2$ $ \Rightarrow $ công thức hóa học của A là: $S{O_2}$
Câu 26 :
Thành phần phần trăm của Cu trong hợp chất CuO là:
Đáp án : C Phương pháp giải :
Công thức tính phần trăm của chất A có trong hợp chất AxByCz là: \(\% A = \dfrac{{{m_A}}}{{{m_{{A_x}{B_y}{C_z}}}}}.100\% = ?\) Lời giải chi tiết :
Phần trăm của Cu có trong CuO là: \(\% Cu = \dfrac{{{m_{Cu}}}}{{{m_{CuO}}}}.100\% = \dfrac{{64}}{{64 + 16}}.100\% = 80\% \)
Câu 27 :
Khi cho đường kính vào nước khuấy lên thấy đường tan thành dạng lỏng (giai đoạn 1). Đun đường lỏng trên chảo một lúc sau có chất màu nâu đỏ chuyển dần thành đen và có mùi khét (giai đoạn 2). Hãy cho biết giai đoạn nào là hiện tượng hóa học?
Đáp án : C Lời giải chi tiết :
Giai đoạn 1: Đường chuyển từ trạng thái rắn sang trạng thái lỏng \( \to\) Hiện tượng vật lý Giai đoạn 2: Các chất có sự thay đổi về màu sắc, mùi, vị \( \to\) Hiện tượng hóa học
Câu 28 :
Đốt cháy m gam chất Y cần dùng 6,4 g oxi thu được 4,4 gam khí CO2 và 3,6 g H2O. Khối lượng m có giá trị nào sau đây:
Đáp án : C Lời giải chi tiết :
Áp dụng định luật bảo toàn khối lượng mY + mO2= mH2O + mCO2 => mY = mH2O + mCO2 - mO2= 4,4 + 3,6 – 6,4 = 1,6g
Câu 29 :
Cho phản ứng: 2H2 + O2 \(\xrightarrow{{{t^0}}}\) 2H2O Nếu khối lượng của O2 là 3,2g; của H2O là 3,6g thì khối lượng của hiđro là bao nhiêu gam?
Đáp án : C Phương pháp giải :
Áp dụng định luật bảo toàn khối lượng ta có: mH2 + mO2 = mH2O Lời giải chi tiết :
2H2 + O2 \(\xrightarrow{{{t^0}}}\) 2H2O Áp dụng định luật bảo toàn khối lượng ta có: mH2 + mO2 = mH2O => mH2 = mH2O – mO2 = 3,6 – 3,2 = 0,4 (gam)
Câu 30 :
Cho phương trình hóa học: AgNO3 \(\xrightarrow{{{t^0}}}\) Ag + NO2 + O2 Sử dụng phương pháp cân bằng kim loại – phi kim cân bằng phương trình trên và cho biết tỉ lệ hệ số các chất trong phương trình lần lượt là:
Đáp án : B Phương pháp giải :
Cân bằng theo thứ tự O, Ag, N. Lời giải chi tiết :
PTHH: AgNO3 \(\xrightarrow{{{t^0}}}\) Ag + NO2 + O2 - Đầu tiên ta cân bằng nguyên tố O - Ta thấy ở VP có tổng 4 nguyên tử trong NO2 và O2 còn VT có 3 nguyên tử O trong AgNO3 → cần làm chẵn số nguyên tử O ở VT bằng cách đặt 2 trước AgNO3. => 2AgNO3 \(\xrightarrow{{{t^0}}}\) Ag + NO2 + O2 - Tiếp theo ta thấy VT có 2 nguyên tử Ag trong AgNO3 còn VP chỉ có 1 nguyên tử Ag → Đặt hệ số 2 trước Ag. => 2AgNO3 \(\xrightarrow{{{t^0}}}\) 2Ag + NO2 + O2 - Tương tự ta thấy VT có 2 nguyên tử N trong AgNO3 còn VP chỉ có 1 nguyên tử N → Đặt hệ số 2 trước NO2. => 2AgNO3 \(\xrightarrow{{{t^0}}}\) 2Ag + 2NO2 + O2 Vậy sau khi cân bằng hệ số các chất trong phương trình lần lượt là 2:2:2:1
Câu 31 :
Cân bằng phương trình hóa học sau: C2H7N + O2 \(\xrightarrow{{{t^0}}}\) CO2 + H2O + N2 và cho biết hệ số của phân tử O2 sau khi cân bằng
Đáp án : D Phương pháp giải :
Sử dụng phương pháp cân bằng phản ứng cháy hợp chất hữu cơ + Cân bằng C + Cân bằng H + Cân bằng N + Cuối cùng cân bằng O Lời giải chi tiết :
- Ta thấy VT có 2 nguyên tử C trong C2H7N còn VP chỉ có 1 nguyên tử C trong CO2 → đặt hệ số 2 trước CO2 - Ta thấy VT có 7 nguyên tử H trong C2H7N còn VP chỉ có 2 nguyên tử H trong H2O → đặt hệ số 7/2 trước H2O - Ta thấy VT có 1 nguyên tử N trong C2H7N còn VP chỉ có 2 nguyên tử N trong N2 → đặt hệ số 1/2 trước N2 => PTHH lúc này: C2H7N + O2 \(\xrightarrow{{{t^0}}}\) 2CO2 + 7/2H2O + 1/2N2 - Tiếp ta thấy VP có 15/2 nguyên tử O (có 4 trong CO2 và 7/2 trong H2O) còn VT có 2 nguyên tử O → đặt hệ số 15/4 trước O2 PTHH: C2H7N + 15/4O2 \(\xrightarrow{{{t^0}}}\) 2CO2 + 7/2H2O + 1/2N2 - Nhân tất cả hệ số với mẫu số chung 4 ta được PTHH: 4C2H7N + 15O2 \(\xrightarrow{{{t^0}}}\) 8CO2 + 14H2O + 2N2 → Hệ số của O2 là 15
Câu 32 :
Biết rằng nhôm Al tác dụng với khí oxi tạo ra chất Al2O3. Lập phương trình hóa học của phản ứng và cho biết tỉ lệ số nguyên tử Al lần lượt với số phân tử của hai chất khác trong phản ứng.
Đáp án : B Lời giải chi tiết :
PTHH: \(4Al + {\text{ }}3{O_2}\xrightarrow{{{t^0}}}2A{l_2}{O_3}\) Tỉ lệ: nguyên tử Al: phân tử O2: phân tử Al2O3 = 4: 3: 2.
Câu 33 :
Cân bằng phương trình hóa học sau: C3H4O + O2 \(\xrightarrow{{{t^0}}}\) CO2 + H2O và cho biết hệ số của nguyên tố O2 sau khi phương trình cân bằng
Đáp án : C Phương pháp giải :
Sử dụng phương pháp cân bằng phản ứng cháy hợp chất hữu cơ + Cân bằng C + Cân bằng H + Cuối cùng cân bằng O Lời giải chi tiết :
- Ta thấy VT có 3 nguyên tử C trong C3H4O còn VP chỉ có 1 nguyên tử C trong CO2 → đặt hệ số 3 trước CO2 - Ta thấy VT có 4 nguyên tử H trong C3H4O còn VP chỉ có 2 nguyên tử H trong H2O → đặt hệ số 2 trước H2O => PTHH lúc này: C3H4O + O2 \(\xrightarrow{{{t^0}}}\) 3CO2 + 2H2O - Tiếp ta thấy VP có 8 nguyên tử O (có 6 trong CO2 và 2 trong H2O) còn VT có 3 nguyên tử O (1 trong C3H4O và 2 trong O2) → đặt hệ số 3.5 trước O2 PTHH: C3H4O + 3.5O2 \(\xrightarrow{{{t^0}}}\) 3CO2 + 2H2O Vậy hệ số của O2 khi cân bằng là 3.5.
Câu 34 :
Biết rằng khí etilen C2H4 cháy là phản ứng xảy ra với oxi O2, sinh ra CO2 và nước. Lập phương trình hóa học của phản ứng và cho biết phát biểu nào sau đây sai
Đáp án : D Lời giải chi tiết :
Phương trình hóa học: C2H4 + 3O2 → 2CO2 + 2H2O
Câu 35 :
Hợp chất A tạo bởi H và nhóm nguyên tử (XOy) hóa trị III. Biết rằng phân tử khối của A nặng bằng phân tử khối H2SO4 và nguyên tố oxi chiếm 65,31% về khối lượng của A. Công thức hóa học của hợp chất A là
Đáp án : C Phương pháp giải :
B1: Viết CTHH của hợp chất A theo quy tắc hóa trị B2: Tính phân tử khối của H2SO4 B3: Tính phân tử khối của A theo MX và y và cho bằng phân tử khối của H2SO4 => được PT(1) B4: Vì guyên tố oxi chiếm 65,31% khối lượng của A => $\% {m_O} = \dfrac{{y.{M_O}}}{{{M_{{H_3}X{O_y}}}}}.100\% $ => tìm y sau đó thay vào (1) được MX Lời giải chi tiết :
H có hóa trị I và nhóm nguyên tử (XOy) hóa trị III => công thức hóa học của hợp chất A có dạng: H3XOy Ta có: ${M_{{H_2}S{O_4}}} = 2.1 + 32 + 16.4 = 98$ => Phân tử khối của A là: ${M_{{H_3}X{O_y}}} = 3.1 + {M_X} + 16.y = 98 = > {M_X} + 16y = 95$ (1) Nguyên tố oxi chiếm 65,31% khối lượng của A => $\% {m_O} = \dfrac{{y.{M_O}}}{{{M_{{H_3}X{O_y}}}}}.100\% $ $ \Rightarrow \dfrac{{16y}}{{98}}.100\% = 65,31\% = > y = 4$ Thay y = 4 vào (1) ta có: MX + 16.4 = 95 => MX = 31 Dựa vào bảng nguyên tố SGK – trang 42, nguyên tố có nguyên tử khối 31 là P => Công thức hóa học của hợp chất A là: H3PO4 |


















