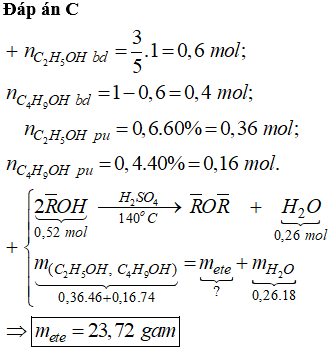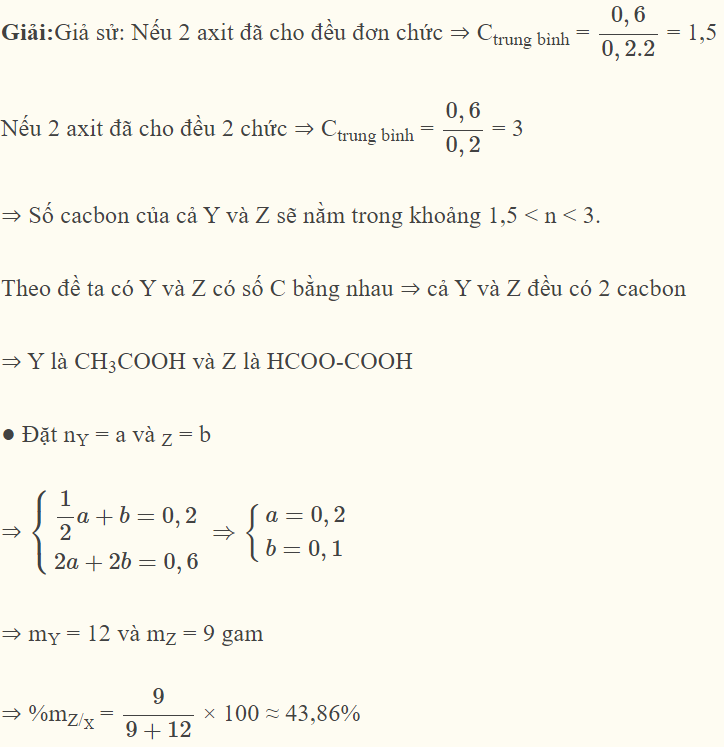Đề khảo sát chất lượng đầu năm Hóa 12 - Đề số 7Đề bài
Câu 1 :
Có bao nhiêu hợp chất hữu cơ C7H8O vừa tác dụng với Na, vừa tác dụng với NaOH
Câu 2 :
Công thức phân tử của ancol no, đơn chức, mạch hở là
Câu 3 :
Khi đốt than trong phòng kín sinh ra khí độc nào?
Câu 4 :
Cho 4,68 gam một kim loại M vào nước dư, sau khi phản ứng xảy ra hoàn toàn thu được 1,344 lít khí H2 (đktc). Kim loại M là
Câu 5 :
Để khử mùi tanh của cá, người ta có thể sử dụng giấm (do có axit axetic) hoặc rượu, bia (do có etanol). Công thức của axit axetic và etanol lần lượt là
Câu 6 :
Cho kim loại X tác dụng với dung dịch H2SO4 loãng rồi lấy khí thu được để khử oxit của kim loại Y. Hai kim loại X và Y lần lượt là
Câu 7 :
Để phân biệt 3 mẫu hóa chất riêng biệt: Phenol, axit acrylic, axit axetic bằng một thuốc thử, người ta dùng thuốc thử là
Câu 8 :
Phản ứng đặc trưng của hidrocacbon no, mạch hở là
Câu 9 :
Số đồng phân cấu tạo có công thức phân tử là C5H12 là
Câu 10 :
Khi clo hóa C5H12 với tỉ lệ mol 1:1 thu được 3 sản phẩm thế monoclo. Danh pháp IUPAC của ankan đó là
Câu 11 :
Chất nào sau đây thuộc loại chất điện ly mạnh?
Câu 12 :
Tổng hệ số (nguyên, tối giản) của tất cả các chất trong phương trình phản ứng giữa Cu với dung dịch HNO3 đặc, nóng là
Câu 13 :
Các ion có thể cùng tồn tại trong một dung dịch là
Câu 14 :
Hòa tan hoàn toàn 9,2 gam hỗn hợp Mg, Fe bằng dung dịch HCl dư thu được 5,6 lít H2 (đktc) và dung dịch X. Cô cạn dung dịch X thu được khối lượng muối khan là
Câu 15 :
Cho dung dịch Ba(OH)2 vào dung dịch chất X, thu được kết tủa màu trắng tan trong axit clohiđric. Chất X là
Câu 16 :
Hợp chất X có %C = 54,54%; %H = 9,1% còn lại là oxi. Khối lượng phân tử của X bằng 88. CTPT của X là
Câu 17 :
Cho sơ đồ chuyển hóa: Glucozo → X → Y → CH3COOH
Câu 18 :
Cho 16,1 gam hỗn hợp X gồm CaCO3 và MgCO3 (có tỉ lệ mol 1:1) tan hết trong dung dịch HCl dư, thu được V lít (đktc) khí CO2. Giá trị của V là
Câu 19 :
Ure là một trong những loại phân bón hóa học phổ biến trong nông nghiệp. Ure thuộc loại
Câu 20 :
Có một hỗn hợp khí gồm CH4, C2H4 và C2H2. Muốn tách lấy C2H2 cần các hóa chất nào sau đây.
Câu 21 :
Cho 44 gam dung dịch NaOH (10%) vào 10 gam dung dịch axit H3PO4 (39,2%). Sau phản ứng trong dung dịch có muối
Câu 22 :
Hỗn hợp X có tỉ khối so với H2 là 21 gồm propan, propen và propin. Khi đốt cháy hoàn toàn 0,1 mol X, tổng khối lượng của CO2 và H2O thu được là
Câu 23 :
Cho 24,6 gam hỗn hợp gồm HCOOH, CH3COOH, C6H5OH tác dụng vừa đủ với 400 ml dung dịch NaOH 1M. Tổng khối lượng muối thu được sau phản ứng là.
Câu 24 :
Đun nóng V lít hơi anđehit X với 3V lít khí H2 (xúc tác Ni) đến khi phản ứng xảy ra hoàn toàn chỉ thu được một hỗn hợp khí Y có thể tích 2V lít (các thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất). Ngưng tụ Y thu được chất Z, cho Z tác dụng với Na sinh ra H2 có số mol bằng số mol Z đã phản ứng. Chất X là anđehit
Câu 26 :
Cho m gam hỗn hợp X gồm ancol metylic và phenol phản ứng hoàn toàn với Na dư, thu được 1,68 lít khí H2 (đktc). Nếu cho cùng lượng hỗn hợp X trên tác dụng với Br 2 dư thì thu được 16,55 gam kết tủa trắng. Giá trị của m là
Câu 27 :
Số đồng phân ancol tối đa ứng với CTPT C3H8Ox là
Câu 28 :
Trộn 250ml dung dịch hỗn hợp gồm HCl (0,08M) và H2SO4 (0,01M) với 250ml dung dịch NaOH (a mol/lit) được 500ml dung dịch có pH =12. Giá trị của a là
Câu 29 :
Cho 4,96 gam gồm CaC2 và Ca tác dụng hết với nước được 2,24 lít (đktc) hỗn hợp khí X. Dẫn X qua bột Ni nung nóng một thời gian được hỗn hợp Y. Cho Y qua bình đựng brom dư thấy thoát ra 0,896 lít (đktc) hỗn hợp Z. Cho tỉ khối của Z so với hiđro là 4,5. Độ tăng khối lượng bình nước brom là
Câu 30 :
Cho H2 và 1 olefin có thể tích bằng nhau qua Niken đun nóng ta được hỗn hợp A. Biết tỉ khối hơi của A đối với H2 là 23,2. Hiệu suất phản ứng hiđro hoá là 75%. Công thức phân tử olefin là
Câu 31 :
Cho 6,6 gam một anđehit đơn chức, mạch hở phản ứng với lượng dư AgNO3/NH3 đun nóng, lượng Ag sinh ra cho tác dụng với HNO3 loãng thu được 2,24 lít NO (duy nhất ở đktc). Công thức cấu tạo của X là
Câu 32 :
Cho 4,48 lít khí CO2 (đktc) hấp thụ hết trong 300ml dung dịch KOH 2M thu được dung dịch X. Cô cạn X thu được a gam chất rắn khan. Giá trị của a là
Câu 33 :
Hòa tan hoàn toàn 30 gam hỗn hợp X gồm Mg, Al và Zn trong dung dịch HNO3, sau phản ứng hoàn toàn thu được dung dịch Y và hỗn hợp khí gồm 0,1 mol khí N2O và 0,1 mol NO. Cô cạn dung dịch sau phản ứng thu được 127 gam hỗn hợp muối. Số mol HNO3 đã bị khử là
Câu 34 :
Hòa tan hết 30 gam rắn gồm Mg, MgO, MgCO3 trong HNO3 thấy có 2,15 mol HNO3 phản ứng. Sau phản ứng thu được 4,48 lít (đktc) hỗn hợp khí NO, CO2 có tỉ so với H2 là 18,5 và dung dịch X chứa m gam muối. Giá trị của m là.
Câu 35 :
Hỗn hợp X gồm axit Y đơn chức và axit Z hai chức (Y, Z có cùng số nguyên tử cacbon). Chia X thành 2 phần bằng nhau. Cho phần 1 tác dụng với Na dư thu được 4,48 lít khí H2 ở đktc. Đốt cháy hoàn toàn phần 2 thu được 26,4 gam CO2. Công thức cấu tạo thu gọn của Z và phần trăm khối lượng của Z trong hỗn hợp X lần lượt là.
Lời giải và đáp án
Câu 1 :
Có bao nhiêu hợp chất hữu cơ C7H8O vừa tác dụng với Na, vừa tác dụng với NaOH
Đáp án : D Phương pháp giải :
Để vừa tác dụng với Na, vừa tác dụn với NaOH thì phân tử phải có nhóm -OH gắn vào vòng benzen Lời giải chi tiết :
Nhận xét: C7H8O có 1 nguyên tử oxi, để tác dụng được với cả Na và NaOH thì C7H8O phải là phenol => Công thức phân tử: CH3 – C6H5 – OH. Cố định nhóm -OH thì nhóm -CH3 có 3 vị trí là o, p, m => Có 3 đồng phân
Câu 2 :
Công thức phân tử của ancol no, đơn chức, mạch hở là
Đáp án : D Phương pháp giải :
Ancol đơn chức => Chỉ có 1 O Lời giải chi tiết :
Công thức phân tử của ancol no, đơn chức, mạch ở là CnH2n+2O
Câu 3 :
Khi đốt than trong phòng kín sinh ra khí độc nào?
Đáp án : A Phương pháp giải :
Thành phần của than là cacbon (C) Lời giải chi tiết :
Khi đốt than trong phòng kín sinh ra 2 khí: CO và CO2 Khí CO là khí độc
Câu 4 :
Cho 4,68 gam một kim loại M vào nước dư, sau khi phản ứng xảy ra hoàn toàn thu được 1,344 lít khí H2 (đktc). Kim loại M là
Đáp án : D Phương pháp giải :
M + nH2O → M(OH)n + n/2 H2 nH2 = 0,06 mol Lập luận với n = 1 và n = 2 Lời giải chi tiết :
M + nH2O → M(OH)n + n/2 H2 Ta có: nH2 = 1,344 : 22,4 = 0,06 mol Từ phương trình: nH2 : n/2 = 4,68 : M Với n = 1 => M = 39 Vậy M là Kali (K)
Câu 5 :
Để khử mùi tanh của cá, người ta có thể sử dụng giấm (do có axit axetic) hoặc rượu, bia (do có etanol). Công thức của axit axetic và etanol lần lượt là
Đáp án : B Lời giải chi tiết :
- Axit axetic: CH3COOH - Etanol: C2H5OH
Câu 6 :
Cho kim loại X tác dụng với dung dịch H2SO4 loãng rồi lấy khí thu được để khử oxit của kim loại Y. Hai kim loại X và Y lần lượt là
Đáp án : D Phương pháp giải :
- X đứng trước H trong dãy điện hóa - Kim loại Y đứng sau Al trong dãy điện hóa Lời giải chi tiết :
Fe + H2SO4 → FeSO4 + H2 H2 + CuO → Cu + H2O => X là Fe, Y là Cu
Câu 7 :
Để phân biệt 3 mẫu hóa chất riêng biệt: Phenol, axit acrylic, axit axetic bằng một thuốc thử, người ta dùng thuốc thử là
Đáp án : C Phương pháp giải :
Dùng thuốc thử là dung dịch Br2 Lời giải chi tiết :
Phenol + dung dịch Br2 → Kết tủa Axit acrylic + dung dịch Br2 → Dung dịch Br2 mất màu Axit axetic + dung dịch Br2 → Không hiện tượng
Câu 8 :
Phản ứng đặc trưng của hidrocacbon no, mạch hở là
Đáp án : C Lời giải chi tiết :
Phản ứng đặc trưng của hidrocacbon no, mạch hở là phản ứng thế
Câu 9 :
Số đồng phân cấu tạo có công thức phân tử là C5H12 là
Đáp án : D Phương pháp giải :
Đồng phân mạch cacbon, đồng phân số nhóm chức Lời giải chi tiết :
=> Có 3 đồng phân
Câu 10 :
Khi clo hóa C5H12 với tỉ lệ mol 1:1 thu được 3 sản phẩm thế monoclo. Danh pháp IUPAC của ankan đó là
Đáp án : C Phương pháp giải :
Viết đồng phân của C5H12, dự đoán số sản phẩm thế monoclo Lời giải chi tiết :
A. 2,2 – dimetylpropan: 1 sản phẩm thế monoclo B. 2 – metylbutan: 4 sản phẩm thế monoclo C. pentan: 3 sản phẩm thế monoclo D. 2 – dimetylpropan: sai danh pháp
Câu 11 :
Chất nào sau đây thuộc loại chất điện ly mạnh?
Đáp án : B Phương pháp giải :
Chất điện ly mạnh là chất khi tan trong nước, phân ly hết thành ion Lời giải chi tiết :
A. Điện ly yếu B. Điện ly mạnh C. Điện ly yếu D. Điện ly yếu
Câu 12 :
Tổng hệ số (nguyên, tối giản) của tất cả các chất trong phương trình phản ứng giữa Cu với dung dịch HNO3 đặc, nóng là
Đáp án : B Phương pháp giải :
Sử dụng phương pháp bảo toàn electron Lời giải chi tiết :
3x / Cu0 → Cu2+ + 2e 2x / N+5 + 3e → N+2 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + H2O => Tổng hệ số của Cu và HNO3 = 3 + 8 = 11
Câu 13 :
Các ion có thể cùng tồn tại trong một dung dịch là
Đáp án : C Phương pháp giải :
Để các ion có thể cùng tồn tại trong một dung dịch => Không có sự tạo thành chất kết tủa, chất khí, chất điện li yếu Lời giải chi tiết :
A. AgCl là chất kết tủa B. Mg(OH)2 là chất kết tủa C. 4 ion đều có thể tồn tại trong dung dịch D. H2O là chất điện ly yếu
Câu 14 :
Hòa tan hoàn toàn 9,2 gam hỗn hợp Mg, Fe bằng dung dịch HCl dư thu được 5,6 lít H2 (đktc) và dung dịch X. Cô cạn dung dịch X thu được khối lượng muối khan là
Đáp án : A Phương pháp giải :
nH2 = 5,6 : 22,4 = 0,25 mol Bảo toàn nguyên tố H => nHCl = 2nH2 = 0,25.2 = 0,5 mol Bảo toàn khối lượng Lời giải chi tiết :
nH2 = 5,6 : 22,4 = 0,25 mol Bảo toàn nguyên tố H => nHCl = 2nH2 = 0,25.2 = 0,5 mol Bảo toàn khối lượng: mKL + mHCl = mmuối + mH2 => 9,2 + 0,5.36,5 = mmuối + 0,25.2 => mmuối = 26,95 gam
Câu 15 :
Cho dung dịch Ba(OH)2 vào dung dịch chất X, thu được kết tủa màu trắng tan trong axit clohiđric. Chất X là
Đáp án : B Phương pháp giải :
BaCO3, CaCO3 là chất kết tủa màu trắng, tan trong axit HCl Lời giải chi tiết :
Ba(OH)2 + Ca(HCO3)2 → BaCO3 + CaCO3 + 2H2O BaCO3 + 2HCl → BaCl2 + CO2 + H2O CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Câu 16 :
Hợp chất X có %C = 54,54%; %H = 9,1% còn lại là oxi. Khối lượng phân tử của X bằng 88. CTPT của X là
Đáp án : A Phương pháp giải :
mC = 88 . 0,5454 = 48 mH = 88 . 0,091 = 8 mO = 88 – 48 – 8 = 32 Lời giải chi tiết :
mC = 88 . 0,5454 = 48 = 12.4 => Có 4 C mH = 88 . 0,091 = 8 = 8.1 => Có 8 H mO = 88 – 48 – 8 = 32 => Có 2 O => Công thức phân tử của X là: C4H8O2
Câu 17 :
Cho sơ đồ chuyển hóa: Glucozo → X → Y → CH3COOH
Đáp án : C Phương pháp giải :
Glucozo → CH3CH2OH → CH3CHO → CH3COOH Lời giải chi tiết :
C6H12O6 → 2C2H5OH + 2CO2 C2H5OH + 2CuO → CH3CHO + Cu2O + 2H2O 2CH3CHO + O2 → 2CH3COOH Glucozo → CH3CH2OH → CH3CHO → CH3COOH
Câu 18 :
Cho 16,1 gam hỗn hợp X gồm CaCO3 và MgCO3 (có tỉ lệ mol 1:1) tan hết trong dung dịch HCl dư, thu được V lít (đktc) khí CO2. Giá trị của V là
Đáp án : C Phương pháp giải :
Tính mol của CaCO3 và MgCO3 nCO2 = nX Lời giải chi tiết :
Gọi x là mol của CaCO3 = mol của MgCO3 => x.100 + x. 64 = 0,0875 nCO2 = nCaCO3 + nMgCO3 = 0,0875 + 0,0875 = 0,175 mol => VCO2 = 0,175 . 22,4 = 3,92 lít
Câu 19 :
Ure là một trong những loại phân bón hóa học phổ biến trong nông nghiệp. Ure thuộc loại
Đáp án : A Lời giải chi tiết :
Ure thuộc loại phân đạm
Câu 20 :
Có một hỗn hợp khí gồm CH4, C2H4 và C2H2. Muốn tách lấy C2H2 cần các hóa chất nào sau đây.
Đáp án : D Phương pháp giải :
Trong hỗn hợp khí: CH4, C2H4 và C2H2. Chỉ có C2H2 tác dụng với AgNO3 Lời giải chi tiết :
2AgNO3 + C2H2 + 2NH3 → NH4NO3 + Ag2C2 Ag2C2 + 2HCl → C2H2 + 2AgCl
Câu 21 :
Cho 44 gam dung dịch NaOH (10%) vào 10 gam dung dịch axit H3PO4 (39,2%). Sau phản ứng trong dung dịch có muối
Đáp án : B Phương pháp giải :
nNaOH = 44.0,1:40 = 0,11 mol nH3PO4 = 10.0,392:98 = 0,04 mol Tính tỉ lệ => Muối thu được Lời giải chi tiết :
nNaOH = 44.0,1:40 = 0,11 mol nH3PO4 = 10.0,392:98 = 0,04 mol nNaOH : nH3PO4 = 2,75 => Sau phản ứng trong dung dịch có muối: Na3PO4 và Na2HPO4
Câu 22 :
Hỗn hợp X có tỉ khối so với H2 là 21 gồm propan, propen và propin. Khi đốt cháy hoàn toàn 0,1 mol X, tổng khối lượng của CO2 và H2O thu được là
Đáp án : C Phương pháp giải :
nCO2 = 3nX = 3.0,1 = 0,3 mol mX = 0,1 . 21. 2 = 4,2 gam => mH => nH2O => mH2O Lời giải chi tiết :
nCO2 = 3nX = 3.0,1 = 0,3 mol mX = 0,1 . 21 . 2 = 4,2 gam => mH = 4,2 – 0,3.12 = 0,6 = nH => nH2O = 0,3 mol => m = mCO2 + mH2O = 0,3.44 + 0,3.18 = 18,6 gam
Câu 23 :
Cho 24,6 gam hỗn hợp gồm HCOOH, CH3COOH, C6H5OH tác dụng vừa đủ với 400 ml dung dịch NaOH 1M. Tổng khối lượng muối thu được sau phản ứng là.
Đáp án : A Phương pháp giải :
Áp dụng định luật bảo toàn khối lượng Lời giải chi tiết :
Ta có: nH2O = nNaOH = 0,4 . 1 = 0,4 mol Áp dụng định luật bảo toàn khối lượng: 24,6 + 0,4.40 = mmuối + 0,4.18 => mmuối = 33,40 gam
Câu 24 :
Đun nóng V lít hơi anđehit X với 3V lít khí H2 (xúc tác Ni) đến khi phản ứng xảy ra hoàn toàn chỉ thu được một hỗn hợp khí Y có thể tích 2V lít (các thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất). Ngưng tụ Y thu được chất Z, cho Z tác dụng với Na sinh ra H2 có số mol bằng số mol Z đã phản ứng. Chất X là anđehit
Đáp án : A Phương pháp giải :
- Thể tích khí giảm = thể tích H2 phản ứng => VH2 phản ứng = V + 3V – 2V => VH2 dư => VH2 phản ứng = 2Vandehit - Lại có: andehit + H2 ancol => Trong Y gồm V lít ancol và V lít H2 dư => Z là ancol Lời giải chi tiết :
Ta có thể tích khí giảm chinihs là thể tích H2 phản ứng => VH2 phản ứng = V + 3V – 2V = 2V (lít) => H2 dư Vì phản ứng xảy ra hoàn toàn, H2 dư => VH2 phản ứng = 2Vandehit => Andehit no, 2 chức hoặc andehit đơn chức và có một liên kết đôi (1) Lại có: andehit + H2 ancol => Trong Y gồm V lít ancol và V lít H2 dư => Z là ancol Có nH2 sinh ra từ phản ứng cộng Na = nancol => Ancol có 2 chức (2) Từ (1) và (2) suy ra andehit no, hai chức, mạch hở
Đáp án : D Phương pháp giải :
- Tính số mol ban đầu của C2H5OH và C4H9OH - Tính số mol phản ứng của C2H5OH và C4H9OH Lời giải chi tiết :
Câu 26 :
Cho m gam hỗn hợp X gồm ancol metylic và phenol phản ứng hoàn toàn với Na dư, thu được 1,68 lít khí H2 (đktc). Nếu cho cùng lượng hỗn hợp X trên tác dụng với Br 2 dư thì thu được 16,55 gam kết tủa trắng. Giá trị của m là
Đáp án : A Phương pháp giải :
Khi X + Br2 dư thì chỉ có phenol phản ứng. Từ lượng kết tủa tính được lượng phenol Khi X + Na dư thì cả 2 chất đều phản ứng. Từ lượng H2, phenol tính được lượng CH3OH Lời giải chi tiết :
- X + Br2 dư: C6H5OH + 3Br2 → C6H2(OH)Br3↓ + 3HBr => nC6H5OH = n↓ = 16,55 : 331 = 0,05 mol - X + Na dư: nH2 = 1,68 : 22,4 = 0,075 mol C6H5OH + Na → C6H5ONa + ½ H2 0,05 0,025 CH3OH + Na → CH3Ona + ½ H2 0,1 0,05 => Hỗn hợp X gồm 0,1 mol CH3OH và 0,05 mol C6H5OH => m = 0,1.32 + 0,05.94 = 7,9 gam
Câu 27 :
Số đồng phân ancol tối đa ứng với CTPT C3H8Ox là
Đáp án : C Phương pháp giải :
Xét các trường hợp x =1, 2, 3 Lời giải chi tiết :
x =1: C3H8O => Có 2 đồng phân x = 2: C3H8O2 => Có 2 đồng phân x = 3: C3H8O3 => Có 1 đồng phân
Câu 28 :
Trộn 250ml dung dịch hỗn hợp gồm HCl (0,08M) và H2SO4 (0,01M) với 250ml dung dịch NaOH (a mol/lit) được 500ml dung dịch có pH =12. Giá trị của a là
Đáp án : B Phương pháp giải :
Tính theo PT ion rút gọn: H+ + OH- → H2O Lời giải chi tiết :
Câu 29 :
Cho 4,96 gam gồm CaC2 và Ca tác dụng hết với nước được 2,24 lít (đktc) hỗn hợp khí X. Dẫn X qua bột Ni nung nóng một thời gian được hỗn hợp Y. Cho Y qua bình đựng brom dư thấy thoát ra 0,896 lít (đktc) hỗn hợp Z. Cho tỉ khối của Z so với hiđro là 4,5. Độ tăng khối lượng bình nước brom là
Đáp án : B Phương pháp giải :
Gọi số mol của CaC2 và Ca lần lượt là a và b 64a + 40b = 4,96 (1) a + b = 0,1 (2) X gồm C2H2 và H2 => mX = 1,16 gam Bảo toàn khối lượng Lời giải chi tiết :
Câu 30 :
Cho H2 và 1 olefin có thể tích bằng nhau qua Niken đun nóng ta được hỗn hợp A. Biết tỉ khối hơi của A đối với H2 là 23,2. Hiệu suất phản ứng hiđro hoá là 75%. Công thức phân tử olefin là
Đáp án : A Phương pháp giải :
Gọi số mol của H2 = CnH2n = 1 mol Sau phản ứng số mol khí giảm một lượng đúng bằng số mol H2 phản ứng. Hiệu suất phản ứng là 75% nên số mol H2 phản ứng là 0,75 mol. Áp dụng định luật bảo toàn khối lượng Lời giải chi tiết :
Câu 31 :
Cho 6,6 gam một anđehit đơn chức, mạch hở phản ứng với lượng dư AgNO3/NH3 đun nóng, lượng Ag sinh ra cho tác dụng với HNO3 loãng thu được 2,24 lít NO (duy nhất ở đktc). Công thức cấu tạo của X là
Đáp án : A Phương pháp giải :
- Từ số mol của NO => Số mol của Ag - Xét 2 trường hợp: TH1: HCHO TH2: Không phải là HCHO Lời giải chi tiết :
Câu 32 :
Cho 4,48 lít khí CO2 (đktc) hấp thụ hết trong 300ml dung dịch KOH 2M thu được dung dịch X. Cô cạn X thu được a gam chất rắn khan. Giá trị của a là
Đáp án : D Phương pháp giải :
- Tính số mol của CO2 và KOH => Tính tỉ lệ => Số muối Lời giải chi tiết :
nCO2 = 4,48 : 22,4 = 0,2 mol nKOH = 0,3.2 = 0,6 mol nKOH : nCO2 = 3 > 2 => Chỉ có muối CO32- và KOH dư => a = 38,8 gam
Câu 33 :
Hòa tan hoàn toàn 30 gam hỗn hợp X gồm Mg, Al và Zn trong dung dịch HNO3, sau phản ứng hoàn toàn thu được dung dịch Y và hỗn hợp khí gồm 0,1 mol khí N2O và 0,1 mol NO. Cô cạn dung dịch sau phản ứng thu được 127 gam hỗn hợp muối. Số mol HNO3 đã bị khử là
Đáp án : C Phương pháp giải :
Gọi số mol của NO3- và NH4NO3 là x và y Tính khối lượng muối: 30 + 62x + 80y = 127 Bảo toàn electron: x = 8y + 1,1 Lời giải chi tiết :
Câu 34 :
Hòa tan hết 30 gam rắn gồm Mg, MgO, MgCO3 trong HNO3 thấy có 2,15 mol HNO3 phản ứng. Sau phản ứng thu được 4,48 lít (đktc) hỗn hợp khí NO, CO2 có tỉ so với H2 là 18,5 và dung dịch X chứa m gam muối. Giá trị của m là.
Đáp án : D Phương pháp giải :
Lời giải chi tiết :
Gọi số mol của NO và CO2 là x và y => x + y = 0,2 30x + 44y = 0,2.37 => x = 0,1 mol và y = 0,1 mol => nMgCO3 = nCO2 = 0,1 mol - Gọi số mol của Mg, MgO, NH4NO3 là a, b, c + Bảo toàn e: 2a = 0,1.3 + 8c + 24a + 40b + 8,4 = 30 + Bảo toàn nguyên tố N: 2,15 = 0,1 + 2c + 2(a + b + 0,1) => a = 0,65 y = 0,15 z = 0,125 => mmuối = mMg(NO3)2 + mNH4NO3 = 143,2 gam
Câu 35 :
Hỗn hợp X gồm axit Y đơn chức và axit Z hai chức (Y, Z có cùng số nguyên tử cacbon). Chia X thành 2 phần bằng nhau. Cho phần 1 tác dụng với Na dư thu được 4,48 lít khí H2 ở đktc. Đốt cháy hoàn toàn phần 2 thu được 26,4 gam CO2. Công thức cấu tạo thu gọn của Z và phần trăm khối lượng của Z trong hỗn hợp X lần lượt là.
Đáp án : B Phương pháp giải :
- Giả sử: 2 axit đã cho đều là đơn chức => Ctrung bình Nếu 2 axit đã cho đều là 2 chức => Ctrung bình Số cacbon của cả Y và Z sẽ nằm trong khoảng 1,5 < n <3 Y và Z đều có 2 cacbon Lời giải chi tiết :
|